Γράφοντας Lewis Structures
Η δομή Lewis πήρε το όνομά της από τον Gilbert N. Lewis, ο οποίος ανέπτυξε την ιδέα το 1916. Η ιδέα εισήχθη αργότερα και ονομάστηκε από τον Irving Langmuir το 1920, ο οποίος έδωσε τα εύσημα στον Lewis. Οι δομές Lewis είναι επίσης γνωστές ως δομές ηλεκτρονίων. Ο Lewis εισήγαγε απλούς συμβολισμούς που αντιπροσωπεύουν δεσμό μεταξύ ατόμων και ηλεκτρονίων σθένους που αντιπροσωπεύονται από κουκκίδες στα άτομα. Αυτές οι σημειώσεις ονομάζονται σύμβολα Lewis ή δομή Lewis dot.
Το σύμβολο Lewis για στοιχεία δεύτερης περιόδου είναι
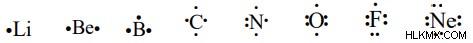
Το σύμβολο Lewis για ορισμένα ανιόντα είναι
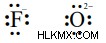
Πώς να σχεδιάσετε διαγράμματα Lewis;
Το άτομο αζώτου έχει πέντε ηλεκτρόνια σθένους και γνωρίζουμε από το διάγραμμα ότι χρειάζεται άλλα τρία ηλεκτρόνια για να επιτύχει μια πλήρη οκτάδα. Το άτομο οξυγόνου έχει έξι ηλεκτρόνια σθένους και γνωρίζουμε ότι απαιτεί δύο ακόμη ηλεκτρόνια για να συμπληρώσει μια πλήρη οκτάδα. Μπορούμε να δούμε από το διάγραμμα ότι το άζωτο θα δώσει τρία ηλεκτρόνια σθένους και το οξυγόνο θα αποκτήσει δύο ηλεκτρόνια σθένους σχηματίζοντας έναν τριπλό δεσμό μεταξύ των δύο ατόμων.
Ας σχεδιάσουμε μια δομή Lewis για το NO3-. Αρχικά, πρέπει να υπολογίσουμε τον αριθμό των ηλεκτρονίων σθένους σε ένα μόριο. Μπορεί να υπολογιστεί προσθέτοντας τον αριθμό της ομάδας όλων των ατόμων και το φορτίο τους. Μετά από αυτό, θα είχαμε λάβει τον αριθμό των ηλεκτρονίων σθένους.
N(ηλεκτρόνιο φλοιού σθένους=5)
O (*3) 18
Χρέωση 1
Σύνολο:24
Ο κανόνας της οκτάδας απαιτεί το κεντρικό άτομο να έχει οκτώ ηλεκτρόνια στο εξωτερικό του περίβλημα. Εάν ξεμείνετε από ηλεκτρόνια πριν σχηματίσετε δεσμούς, πρέπει να δημιουργήσετε πολλαπλούς δεσμούς για να το κάνετε. Ο αριθμός των πολλαπλών δεσμών ποικίλλει ανάλογα με το είδος του στοιχείου με το οποίο ασχολείστε. Εδώ, μπορούμε να δούμε ότι το Ν είναι βραχύ με τα ηλεκτρόνια. Τώρα, μπορούμε να χρησιμοποιήσουμε ένα μοναχικό ζεύγος από το άτομο του Ο, που βρίσκεται στα αριστερά. Ως εκ τούτου, θα σχηματίσει διπλό δεσμό με ένα από το οξυγόνο και θα βοηθήσει στην ολοκλήρωση του δεσμού.
Τώρα, πρέπει να προσδιορίσουμε το επίσημο φορτίο του μορίου. Το τυπικό φορτίο κάθε ατόμου σε ένα μόριο είναι σημαντικό επειδή υποδεικνύει την πολικότητα του μορίου και την κατεύθυνση του δεσμού. Όλα τα άτομα με θετικό τυπικό φορτίο είναι ηλεκτρόφιλα και είναι συνήθως τα επιτιθέμενα είδη στις αντιδράσεις ηλεκτροφιλικής προσθήκης. Τα άτομα με αρνητικό τυπικό φορτίο (που υποδεικνύεται με πρόσημο μείον) είναι πυρηνόφιλα και είναι παραδοσιακά τα επιτιθέμενα είδη στις αντιδράσεις πυρηνόφιλης υποκατάστασης.
Δεν μπορούμε να ολοκληρώσουμε τη δομή Lewis χωρίς τις επίσημες χρεώσεις. Τα πράγματα που χρειάστηκαν σε αυτό είναι τα εξής:
Είναι απαραίτητο τα τυπικά φορτία να είναι ίδια με την ηλεκτραρνητικότητα του ατόμου. Σημαίνει περισσότερα αρνητικά φορτία στα ηλεκτραρνητικά άτομα και λιγότερα θετικά φορτία στα ηλεκτραρνητικά άτομα.
Το επίσημο φορτίο είναι το φορτίο που θα είχε εάν όλοι οι δεσμοί του ήταν εντελώς ιοντικοί. Εάν έχετε μια χρέωση -1 και +1 κοντά μεταξύ τους, μπορείτε συχνά να αναδιατάξετε τα πράγματα έτσι ώστε οι χρεώσεις να ακυρωθούν. Ένας τρόπος για να γίνει αυτό είναι να χρησιμοποιήσετε το μοναχικό ζεύγος ηλεκτρονίων στο άτομο -1 για να σχηματίσετε έναν διπλό δεσμό με το πλησιέστερο +1 άτομο. Αυτό δημιουργεί έναν διπλό δεσμό μεταξύ τους αντί για έναν απλό δεσμό και δεν υπάρχει πλέον καθαρή χρέωση.
Η δομή Lewis για NO3- :
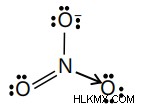
Έχετε προσδιορίσει ότι η "καλύτερη" δομή περιλαμβάνει έναν διπλό δεσμό μεταξύ του αζώτου και ενός από τα οξυγόνα (που φαίνεται με κόκκινο). Αυτό είναι εντάξει, αλλά υπάρχουν διάφοροι τρόποι για να εμφανίσετε αυτές τις πληροφορίες.
Δηλώσεις της Θεωρίας Kossel-Lewis
Ο Κόσελ έχει συζητήσει αρκετά γεγονότα σχετικά με τους χημικούς δεσμούς και τα σημαντικά αξιώματα περιλαμβάνουν τα εξής:
1. Τα άκρως ηλεκτραρνητικά αλογόνα, μαζί με τα εξαιρετικά ηλεκτροθετικά αλκαλικά μέταλλα, φαίνεται να διαχωρίζονται από τα ευγενή αέρια που είναι διαθέσιμα στον περιοδικό πίνακα.
2. Η δημιουργία του αρνητικού ιόντος από το αλογόνο και των θετικών ιόντων από τα μέταλλα των αλκαλίων σχετίζεται με το κέρδος και την απώλεια ηλεκτρονίων.
3. Τα θετικά ιόντα και τα αρνητικά ιόντα κάνουν τη σταθερή ηλεκτρονική διαμόρφωση της διαμόρφωσης ευγενών αερίων.
4. Κάθε ευγενές αέριο του περιοδικού πίνακα έχει τη σταθερή ηλεκτρονική διαμόρφωση της οκτάδας, εξαιρουμένου του Ήλιου που περιλαμβάνει διπλή διαμόρφωση.
Παράδειγμα:λαμβάνοντας υπόψη το σχηματισμό NaCl, NaNaCl, το Na χάνει ένα ηλεκτρόνιο, το οποίο αποκτάται από το χλώριο. Χάνοντας ένα ηλεκτρόνιο, το NaNa θα επιτύχει τη σταθερή διαμόρφωση του Νέον, ενώ το ClCl, όταν αποκτήσει ένα ηλεκτρόνιο, θα αποκτήσει τη σταθερή διαμόρφωση του αργού.
Na → Na++1e–
[Ne]3s1 [Δεν]
Cl+1e– → Cl1-
[Ne]3s23p5 [Ar]
Συμπέρασμα :
Ο αριθμός των κουκκίδων που περιβάλλουν το σύμβολο θα δείξει τον αριθμό των διαθέσιμων ηλεκτρονίων σθένους, κάτι που βοηθά στον υπολογισμό του τυπικού ή ομαδικού σθένους του συγκεκριμένου στοιχείου.
Σύμφωνα με την έννοια των Δομών Lewis, το άτομο που σχετίζεται με διαφορετικά στοιχεία συμμετείχε ενεργά σε συνδυασμό για να ολοκληρώσει την οκτάδα τους (8 ηλεκτρόνια στο εξώτατο κέλυφος σθένους) ή το διπλό (2 ηλεκτρόνια σθένους στο εξωτερικό κέλυφος σθένους )για την επίτευξη της πλησιέστερης διαμόρφωσης ευγενών αερίων. Αυτή η πλήρης διαδικασία είναι γνωστή ως ΚΑΝΟΝΑΣ OCTET.




