Αλλοτρόπες
Ο όρος αλλοτροπία προέρχεται από την αρχαία ελληνική λέξη όπου «άλλος» σημαίνει «άλλος» και «τρόπος» αντιπροσωπεύει «τρόπο ή μορφή». Αναφέρεται στην ιδιότητα των χημικών στοιχείων να υπάρχουν σε μεταβλητές προς διαφορετικές μορφές σε παρόμοια φυσική κατάσταση. Τα αλλότροπα αναφέρονται σε διαφορετικές δομικές αλλαγές σε ένα στοιχείο, δηλαδή τα άτομα ενός στοιχείου συνδέονται μεταξύ τους με μεταβλητό τρόπο. Αυτό μπορεί να φανεί σε αλλότροπα άνθρακα όπως το διαμάντι (εδώ τα άτομα άνθρακα συνδέονται για να σχηματίσουν ένα κρυσταλλικό πλέγμα ή ένα τετράεδρο) γραφίτη (σε αυτόν τα άτομα άνθρακα σχηματίζουν ένα φύλλο εξαγωνικού πλέγματος) και το φουλερένιο (στο οποίο σχηματίζονται τα άτομα άνθρακα μια σφαιρική ή μια σωληνοειδή δομή). Μόνο τα στοιχεία θεωρούνται υπό αλλοτροπία και όχι οι ενώσεις. Ο πολυμορφισμός εξετάζει τις ενώσεις και περιορίζεται μόνο σε στερεά υλικά όπως οι κρύσταλλοι. Στην παρόμοια φυσική κατάσταση η αλλοτροπία αναφέρεται σε μεταβλητές μορφές ενός στοιχείου. Σε λίγα στοιχεία τα αλλότροπα διαθέτουν διαφορετικές κρυσταλλικές δομές και διαφορετικούς μοριακούς τύπους, καθώς και διαφορά στις φυσικές καταστάσεις παρατηρείται επίσης σε δύο διαφορετικά αλλότροπα οξυγόνου όπως το διοξυγόνο O2 και το όζον O3 και τα δύο μπορούν να υπάρχουν σε στερεό, υγρό και αέριο. Στοιχεία που δείχνουν αλλοτρόπα περιλαμβάνουν κασσίτερο, άνθρακα, φώσφορο, θείο και οξυγόνο. Το 1841 ένας Σουηδός χημικός με το όνομα Jons Jakob Berzilius ανακάλυψε την έννοια της αλλοτροπίας.
Ιδιότητες των αλλοτροπών
Τα αλλότροπα παρουσιάζουν διαφορετικές φυσικές και χημικές ιδιότητες.
Οι αλλαγές στις αλλοτροπικές μορφές είναι το αποτέλεσμα της ίδιας δύναμης που επηρεάζει άλλες δομές όπως το φως, η πίεση και η θερμοκρασία.
Η σταθερότητα διαφορετικών αλλοτροπών εξαρτάται από ορισμένες συγκεκριμένες συνθήκες.
Τα αλλότροπα των ίδιων στοιχείων έχουν διαφορετικές ιδιότητες όπως τα αλλοτρόπα του άνθρακα, δηλαδή το διαμάντι και ο γραφίτης έχουν ποικίλες εμφανίσεις, τιμές σκληρότητας, αντιδραστικότητα, σημεία τήξης και βρασμού.
Αλλότροπα του άνθρακα
Ο άνθρακας είναι ένα από τα στοιχεία του περιοδικού πίνακα που δείχνει την αλλοτροπία. Τα αλλότροπα του άνθρακα κατηγοριοποιούνται σε δύο διακριτές μορφές:
Άμορφα αλλότροπα άνθρακα
Κρυσταλλικά αλλότροπα άνθρακα
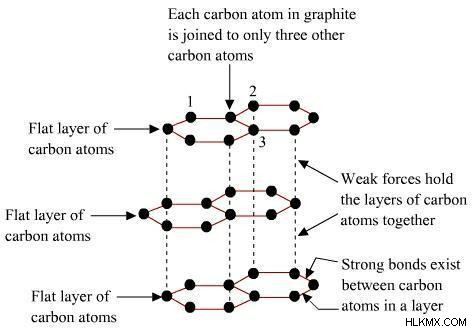
Γραφίτης
Το 1789 ο Abraham Gottlob Wener ανακάλυψε το πιο κοινό αλλοτρόπιο του άνθρακα και το ονόμασε γραφίτη. Είναι το πιο σταθερό και καθαρό αλλοτρόπο άνθρακα. Αποτελείται από ένα επίπεδο δισδιάστατο στρώμα ατόμων άνθρακα διατεταγμένα εξαγωνικά. Χαρακτηρίζεται από μαλακό, μαύρο και ολισθηρό χώμα.
Σε κάθε στιβάδα ένα μεμονωμένο άτομο άνθρακα συνδέεται με τρία άλλα άτομα άνθρακα με τη βοήθεια ομοιοπολικών δεσμών C-C και κάθε άνθρακας υβριδοποιείται sp2. Ο υπόλοιπος τέταρτος δεσμός εμφανίζεται ως π-δεσμός. Καθώς αυτά τα π-ηλεκτρόνια μετατοπίζονται, γίνονται κινητά και βοηθούν στην αγωγή του ηλεκτρισμού. Υπάρχουν γενικά δύο μορφές γραφίτη α και ß. Η μορφή α διαθέτει στρώματα που είναι διατεταγμένα σε μια σειρά ABAB σε σχέση με το τρίτο στρώμα που τοποθετείται πάνω από τα πρώτα στρώματα. Ενώ σε μορφή ß διατάσσεται σε μορφή ABCABC.
Ιδιότητες του γραφίτη
Λόγω της τέλειας στοίβαξης των στρωμάτων το ένα πάνω από το άλλο, αυτό το αλλοτρόπιο άνθρακα μπορεί να λειτουργήσει ως λιπαντικό.
Ο γραφίτης διαθέτει επίσης μια μεταλλική λάμψη που βοηθά στην αγωγή του ηλεκτρισμού, επίσης ο γραφίτης είναι καλός αγωγός της θερμότητας και του ηλεκτρισμού.
Σε υψηλές θερμοκρασίες όπου δεν μπορεί να χρησιμοποιηθεί λάδι, ο γραφίτης χρησιμοποιείται ως ξηρό λιπαντικό.
Μπορεί να χρησιμοποιηθεί για την κατασκευή χωνευτηρίων που διαθέτουν την ιδιότητα της αδράνειας να αραιώνουν οξέα και αλκάλια.
Ο γραφίτης είναι θερμοδυναμικά πιο σταθερός από το διαμάντι.
Διαθέτει μια δομή με στρώσεις σαν κηρήθρα, όπου κάθε στρώμα αποτελείται από επίπεδους εξαγωνικούς δακτυλίους ατόμων άνθρακα. Αυτά τα στρώματα συγκρατούνται μεταξύ τους μέσω των δυνάμεων έλξης Van der Waals.
Στον γραφίτη, 3 άνθρακας σχηματίζει δεσμούς σίγμα και 1 άνθρακας σχηματίζει δεσμό pi.
Διαμάντι
Είναι η πιο καθαρή μορφή άνθρακα. Στο διαμάντι τα άτομα άνθρακα είναι διατεταγμένα στο πλέγμα στη σταθερή κυβική κρυσταλλική δομή με επίκεντρο πρόσωπο. Το διαμάντι έχει πολλές μοναδικές φυσικές ποσότητες που προκύπτουν λόγω ισχυρότερου ομοιοπολικού δεσμού μεταξύ των ατόμων. Κάθε άτομο χαρτοκιβωτίου συνδέεται ομοιοπολικά και τετραεδρικά με τέσσερα άλλα άτομα άνθρακα. Αυτό το τετράεδρο μαζί συνθέτει ένα τρισδιάστατο δίκτυο εξαμελών δακτυλίων άνθρακα σε διαμόρφωση καρέκλας και έτσι παρέχει μια τάση μηδενικής γωνίας δεσμού. Αυτό το 3d ομοιοπολικά συνδεδεμένο δίκτυο έχει αποδειχθεί ότι είναι ο κύριος λόγος για την ισχυρή αντοχή του διαμαντιού.
Ιδιότητες του Διαμαντιού 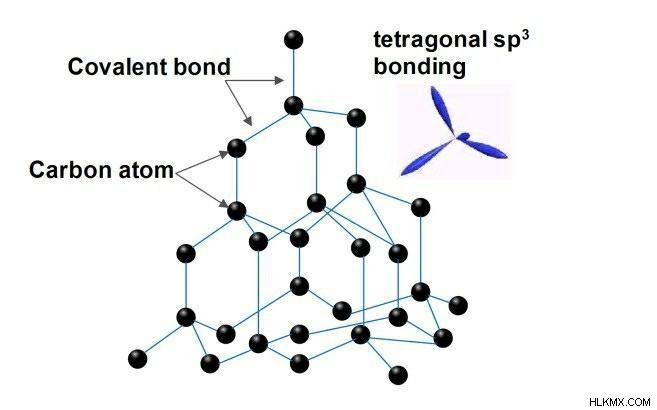
Είναι πολύ σκληρό και ισχυρό ως ουσία.
Διαθέτει υψηλά σημεία τήξης
Διαθέτουν υψηλή σχετική πυκνότητα και είναι διαφανή στις ακτίνες Χ.
Τα διαμάντια έχουν υψηλή τιμή δείκτη διάθλασης.
Είναι κακός αγωγός του ηλεκτρισμού αλλά καλός αγωγός της θερμότητας.
Είναι ως επί το πλείστον αδιάλυτα σε όλους τους διαλύτες.
Άμορφος άνθρακας
Αναφέρεται σε άνθρακα που δεν έχει κρυσταλλική δομή. Η αναλογία των υβριδοποιημένων δεσμών sp2 προς sp3 που υπάρχουν σε ένα υλικό απεικονίζει τις ιδιότητες του άμορφου άνθρακα. Τα υλικά πλούσια σε υβριδισμένους δεσμούς sp3 είναι γνωστά ως τετραεδρικός άμορφος άνθρακας ή άνθρακες τύπου διαμαντιού.
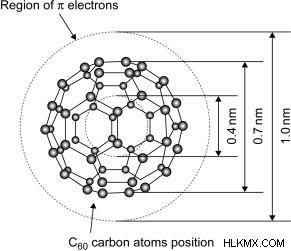
Φουλερένιο
Το 1985 ο καθηγητής Harry Kroto από το Πανεπιστήμιο του Sussex ανακάλυψε το C60 και το ονόμασε buckminsterfullerene. Μέχρι αυτή την ανακάλυψη υπήρχαν μόνο δύο αλλότροπα άνθρακα:το διαμάντι και ο γραφίτης. Είναι μια σφαιρική δομή που αποτελείται από 60 άτομα άνθρακα όπου 20 άτομα άνθρακα είναι διατεταγμένα ως εξάγωνο και 12 από αυτά ως πεντάγωνο, τα άτομα άνθρακα είναι υβριδισμένα sp2. Το σχήμα του μοιάζει με ποδόσφαιρο, γι' αυτό μερικές φορές αναφέρεται και ως "buckyball". Έχουν χαμηλές διαμοριακές δυνάμεις και χαμηλά σημεία τήξης. Αποτελείται από μια θάλασσα ηλεκτρονίων που τα βοηθά να μεταφέρουν ηλεκτρισμό. Έχουν την ικανότητα να διαλύονται σε οργανικό διαλύτη.
Συμπέρασμα
Αυτό το σύστημα αλλοτροπών άνθρακα διαθέτει ένα ευρύ φάσμα άκρων. Όπως και στο διαμάντι, ο δεσμός που συγκρατεί όλα τα άτομα άνθρακα μαζί είναι πολύ ισχυρός και κάνει το διαμάντι το πιο σκληρό από όλα, ενώ αυτοί οι ίδιοι δεσμοί είναι πιο αδύναμοι στον γραφίτη. Στο διαμάντι οι δεσμοί είναι άκαμπτοι και σχηματίζουν ένα τρισδιάστατο δίκτυο, ενώ στον γραφίτη ο δεσμός σχηματίζει εξαγωνικά φύλλα, αυτά τα φύλλα μπορούν να γλιστρήσουν το ένα πάνω στο άλλο και να κάνουν τον γραφίτη μαλακό στη φύση. Ελπίζουμε ότι αυτό το άρθρο παρείχε μια σαφή ιδέα για τα αλλοτρόπα, τις ιδιότητές τους μαζί με τα διαφορετικά αλλοτρόπα του άνθρακα.




