Μοριακή μάζα και πώς να τη βρείτε
Στη χημεία, η μοριακή μάζα είναι η μάζα σε γραμμάρια ανά mole (g/mol) ή χιλιόγραμμα ανά mole (kg/mol) μιας ουσίας. Η μοριακή μάζα είναι μια έντονη ιδιότητα της ύλης, που σημαίνει ότι η τιμή της δεν εξαρτάται από το μέγεθος του δείγματος.
Πώς να βρείτε τη μοριακή μάζα
Ακολουθήστε αυτά τα απλά βήματα για να βρείτε τη μοριακή μάζα μιας ένωσης:
- Ξεκινήστε με τον χημικό τύπο.
- Χρησιμοποιώντας έναν περιοδικό πίνακα, αναζητήστε την ατομική μάζα κάθε στοιχείου στον τύπο. (Σημείωση:Χρησιμοποιήστε διαφορετικές τιμές εάν εργάζεστε με γνωστό ισότοπο.)
- Προσθέστε τις τιμές ατομικής μάζας κάθε στοιχείου, σύμφωνα με τον χημικό τύπο. Για κάθε στοιχείο, πολλαπλασιάστε την ατομική μάζα με τον δείκτη που ακολουθεί το σύμβολό του. Εάν δεν υπάρχει δείκτης, είναι το ίδιο με τον πολλαπλασιασμό με το "1".
Παράδειγμα #1:Βρείτε τη μοριακή μάζα ενός στοιχείου
Για παράδειγμα, βρείτε τη μάζα ενός mole νατρίου. Κάντε αυτό αναζητώντας νάτριο (Na) στον περιοδικό πίνακα. Η σχετική ατομική μάζα είναι ίδια με τη μοριακή μάζα (εκτός από την γραμμομοριακή μάζα σε g/mol). Η μοριακή μάζα του νατρίου είναι 22,99 g/mol. Τώρα, ξέρετε ότι ο ατομικός αριθμός του νατρίου είναι 11, οπότε μπορεί να αναρωτιέστε γιατί η μοριακή μάζα δεν είναι ακριβώς 22 (11 πρωτόνια και 11 νετρόνια). Αυτό συμβαίνει επειδή η μέση αφθονία ισοτόπων νατρίου στον φλοιό της Γης περιλαμβάνει άλλα ισότοπα εκτός από το νάτριο-22. Θυμηθείτε, η μοριακή μάζα είναι μέση μάζα ανά mole.
Ως άλλο παράδειγμα, βρείτε τη μάζα ενός mol αερίου οξυγόνου. Το αέριο οξυγόνο είναι ένα διατομικό μόριο (O2 ). Αρχικά, αναζητήστε την ατομική μάζα (ατομικό βάρος) του στοιχείου, που είναι 16,00. Στη συνέχεια, πολλαπλασιάστε αυτήν την τιμή επί 2 (ο δείκτης που ακολουθεί το σύμβολο για το οξυγόνο, O). Η μοριακή μάζα του O2 είναι 16,00 x 2 =32,00 g/mol.
Παράδειγμα #2:Βρείτε τη μοριακή μάζα του NaCl
Εφαρμόστε το ίδιο βήμα και βρείτε τη μοριακή μάζα επιτραπέζιου αλατιού ή NaCl.
- Ο τύπος είναι NaCl.
- Ατομική μάζα Na =22,99; ατομική μάζα Cl =35,45.
- Μοριακή μάζα NaCl =22,99 + 35,45 g/mol.
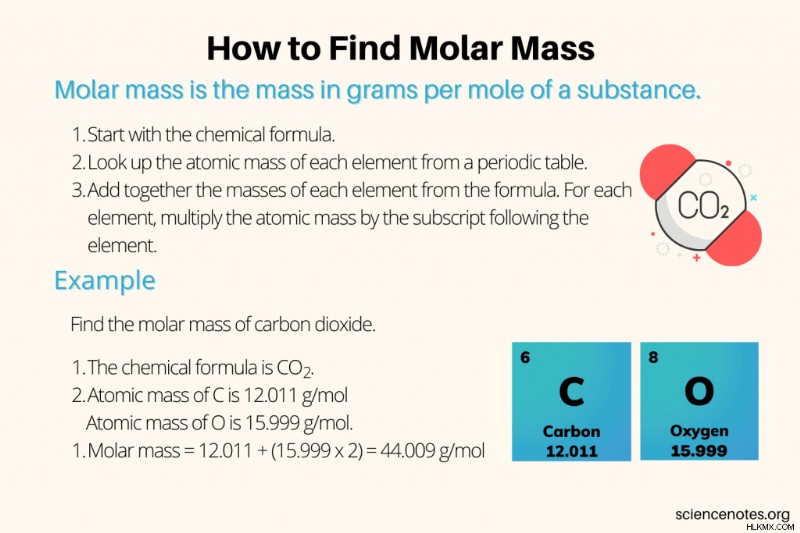
Παράδειγμα #3:Βρείτε τη μοριακή μάζα του CO2
Βρείτε τη μοριακή μάζα του διοξειδίου του άνθρακα:
- Ο τύπος είναι CO2.
- Ατομική μάζα C =12,01; ατομική μάζα Ο =16,00.
- Μοριακή μάζα CO2 =12,01 + (16,00 x 2) =44,01 g/mol
Μοριακή μάζα έναντι μοριακής μάζας
Τις περισσότερες φορές, οι άνθρωποι χρησιμοποιούν τους όρους «μοριακή μάζα» και «μοριακή μάζα» εναλλακτικά. Όμως, δεν είναι ακριβώς ίδια μεταξύ τους.
Πρώτον, η μοριακή μάζα είναι είτε χωρίς μονάδα είτε αναφέρεται σε dalton (Da) ή μονάδες ατομικής μάζας (amu ή u). Από την άλλη πλευρά, η μονάδα για τη μοριακή μάζα είναι γραμμάρια ανά mole (g/mol) ή χιλιόγραμμα ανά mole (kg/mol).
Δεύτερον, η μοριακή μάζα περιγράφει τη μάζα ενός μόνο μορίου ή ενός τύπου μορίου. Εν τω μεταξύ, η μοριακή μάζα είναι μια ιδιότητα όγκου, που αντανακλά τη μέση μάζα των σωματιδίων σε ένα υλικό. Με άλλα λόγια, ο μέσος χημικός τύπος και η αναλογία ισοτόπων των στοιχείων έχουν σημασία.
Έτσι, η μοριακή μάζα του NaCl είναι πιθανώς διαφορετική σε ένα δείγμα από τη Γη σε σχέση με ένα δείγμα που συλλέγεται στην Αφροδίτη λόγω των μικρών διακυμάνσεων στην αφθονία των ισοτόπων των στοιχείων. Ένα πιο κοινό σενάριο είναι ο υπολογισμός της μοριακής μάζας ενός δείγματος ενός πολυμερούς που περιέχει διαφορετικούς αριθμούς μονομερών υπομονάδων. Μια άλλη χρήση της μοριακής μάζας είναι η εύρεση μέσης μάζας ανά mol DNA ή RNA, τα οποία περιέχουν ποικίλους αριθμούς διαφορετικών νουκλεοτιδίων. Η μοριακή μάζα βρίσκει αξία σε μείγματα, όπου η μοριακή μάζα δεν ισχύει.
Αναφορές
- International Union of Pure and Applied Chemistry (1993). Ποσότητες, μονάδες και σύμβολα στη Φυσικοχημεία (2η έκδ.). Oxford:Blackwell Science. ISBN 0-632-03583-8.
- IUPAC (1997). «Σχετική μοριακή μάζα». Compendium of Chemical Terminology (the “Gold Book”) (2η έκδ.). Oxford:Blackwell Scientific Publications. doi:10.1351/goldbook.R05270
- International Bureau of Weights and Measures (2006). Το Διεθνές Σύστημα Μονάδων (SI) (8η έκδ.). ISBN 92-822-2213-6.
- Possolo, Antonio; van der Veen, Adriaan M. H.; Meija, Juris; Hibbert, D. Brynn (2018). «Ερμηνεία και διάδοση της αβεβαιότητας των τυπικών ατομικών βαρών (Τεχνική Έκθεση IUPAC)». Καθαρή και Εφαρμοσμένη Χημεία . 90 (2):395–424. doi:10.1515/pac-2016-0402