Τρυγικό οξύ
Το τρυγικό οξύ είναι ένα οργανικό οξύ που υπάρχει σε μια ποικιλία λαχανικών και φρούτων, συμπεριλαμβανομένων των μπανανών, των σταφυλιών, των εσπεριδοειδών και των ταμαρίνδων. Είναι επίσης γνωστό ως Ρακεμικό οξύ ή 2,3-διυδροξυηλεκτρικό οξύ. Χρησιμοποιείται για την παραγωγή διοξειδίου του άνθρακα. Είναι ένα κρυσταλλικό λευκό διπρωτικό αλδαρικό οξύ που είναι διπρωτικό. Χρησιμοποιείται συνήθως στη φαρμακοβιομηχανία. Μια υψηλή ποσότητα τρυγικού οξέος μπορεί να προκαλέσει θάνατο ή παράλυση.
Ιδιότητες του τρυγικού οξέος:
Διατίθεται σε διάφορες λευκές κοκκώδεις έως κρυσταλλικές μορφές.
Είναι μια άοσμη ουσία.
Έχει μια αναζωογονητική όξινη γεύση.
Το σημείο τήξης αυτής της ουσίας είναι 173.625 βαθμοί Κελσίου.
Το σημείο ανάφλεξης αυτού του υλικού είναι 210 βαθμοί Κελσίου.
Είναι υδατοδιαλυτό.
Έχει μοριακή μάζα 150,087 γραμμάρια ανά mol.
Ζυγίζει 1,79 g/mol και πυκνότητα 1,79 g/mol.
Το τρυγικό οξύ είναι μια δραστική ουσία που βρίσκεται στη φύση.
Δομή του τρυγικού οξέος:
Το τρυγικό οξύ έχει δύο ομάδες OH και δύο COOH, καθιστώντας το διυδροξυ και δικαρβοξυλικό οξύ. Το D-τρυγικό οξύ, το L-τρυγικό οξύ και το μεσο-τρυγικό οξύ είναι χειρόμορφα μόρια με χαρακτηριστικά στερεοϊσομερισμού.
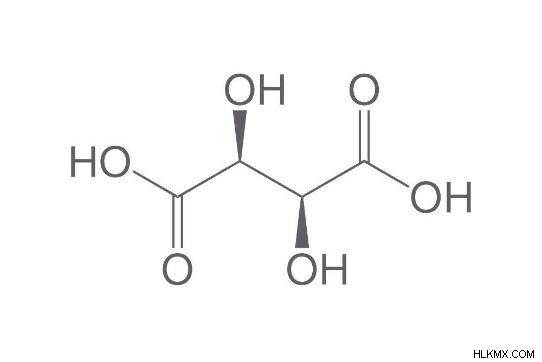
Χημικός τύπος τρυγικού οξέος:
4 άτομα άνθρακα, 6 άτομα υδρογόνου και 6 άτομα οξυγόνου αποτελούν το τρυγικό οξύ. Έχει δύο ομάδες υδροξυλίου και δύο δικαρβοξυλικές ομάδες και έχει μοριακό βάρος 150,09 g/mole. Ο χημικός τύπος για το διυδροξυβουτανοδιοϊκό οξύ (τρυγικό οξύ) είναι ο ακόλουθος:
Χημικός τύπος: (CH(OH)COOH)2
Μοριακός τύπος:C4H6O6
Χρήσεις τρυγικού οξέος:
Χρησιμοποιείται για να κάνει τα από του στόματος φάρμακα να έχουν καλύτερη γεύση.
Είναι ένας χηλικός παράγοντας για μεταλλικά ιόντα όπως το μαγνήσιο και το ασβέστιο.
Χρησιμοποιείται, μαζί με τη μαγειρική σόδα, ως διογκωτικό σε συνταγές.
Είναι ένας τύπος αντιοξειδωτικού.
Είναι ένα από τα πιο σημαντικά οξέα στο κρασί.
Χρησιμοποιείται για να προσδώσει μια ξινή γεύση στα γεύματα.
Μερικές φορές χρησιμοποιείται για να κάνει τους ανθρώπους να κάνουν εμετό.
Οι ασημένιοι καθρέφτες κατασκευάζονται από αυτό.
Χρησιμοποιείται στον χρωματισμό υφασμάτων στην εστερική του μορφή.
Χρησιμοποιείται στη διαδικασία μαυρίσματος δέρματος.
Βρίσκεται σε καραμέλες.
Χρησιμοποιείται ως σταθεροποιητής τροφίμων σε μορφή κρέμας.
Μαγειρική σόδα:
Η κρυσταλλική δομή του διττανθρακικού νατρίου, γνωστή και ως όξινο ανθρακικό νάτριο, είναι μονοκλινική. Το έτος 1791, ένας Γάλλος χημικός ονόματι Nicolas Leblanc δημιούργησε ανθρακικό νάτριο. Ο Austin Church και ο John Dwight, δύο αρτοποιοί της Νέας Υόρκης, ίδρυσαν το πρώτο εργοστάσιο για την παρασκευή μαγειρικής σόδας το 1846. Είναι μια εκδοχή σε σκόνη μιας λευκής στερεής κρυσταλλικής χημικής ουσίας. Τα ιόντα νατρίου και τα διττανθρακικά ιόντα αποτελούν αυτό το άλας. Το NaHC03 είναι ο μοριακός του τύπος. Είναι ένα σαθρό θεμέλιο. Η μαγειρική σόδα είναι η δημοφιλής ονομασία αυτού του συστατικού, το οποίο χρησιμοποιείται στη μαγειρική. Το επίπεδο pH είναι περίπου 8,31.
Ιδιότητες διττανθρακικού νατρίου:
Η φύση του είναι ασθενώς βασική. Επειδή το διττανθρακικό νάτριο υδρολύεται, ένα διάλυμα διττανθρακικού νατρίου είναι μετρίως αλκαλικό.
Το pH ενός διαλύματος διττανθρακικού νατρίου είναι 8,3.
Δεν υπάρχει αλλαγή χρώματος με τη φαινολοφθαλεΐνη, αλλά το πορτοκαλί μεθυλίου παράγει ένα κίτρινο χρώμα.
Είναι ελάχιστα διαλυτό στο νερό.
Έχει σημείο βρασμού 8510 βαθμούς Κελσίου και σημείο τήξης 500 βαθμούς Κελσίου.
Το μοριακό βάρος ή η μοριακή μάζα είναι 84,0066 g/mol.
Αποσυντίθεται όταν θερμαίνεται, απελευθερώνοντας αέριο διοξείδιο του άνθρακα και σχηματίζοντας ανθρακικό νάτριο.
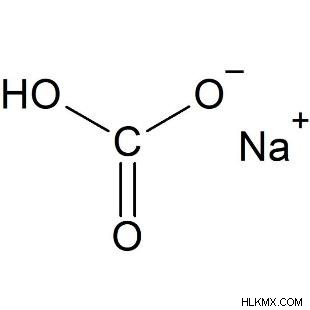
Δομή διττανθρακικού νατρίου:
Ο χημικός τύπος για το διττανθρακικό νάτριο είναι NaHC03.
Ένα κατιόν νατρίου (Na+) και ένα διττανθρακικό ανιόν αποτελούν αυτό το ιόν (HCO3-).
Η δομή του πλέγματος είναι μονοκλινική.
Ένα άτομο νατρίου, ένα άτομο άνθρακα, ένα άτομο υδρογόνου και τρία άτομα οξυγόνου αποτελούν αυτήν την ένωση.
Χρήσεις διττανθρακικού νατρίου:
Χρησιμοποιείται για τη θανάτωση κατσαρίδων και τον περιορισμό της ανάπτυξης μυκήτων ως φυτοφάρμακο.
Χρησιμοποιείται ως απολυμαντικό και για να διατηρεί τις μασχάλες απαλλαγμένες από οσμές και ερεθισμούς.
Χρησιμοποιείται στην κουζίνα, κυρίως για το ψήσιμο φαγητών.
Χρησιμοποιείται στην ιατρική για την αποφυγή παρενεργειών της χημειοθεραπείας με ενδοφλέβια χορήγηση.
Λόγω των αντιβακτηριακών χαρακτηριστικών του, χρησιμοποιείται για τον καθαρισμό ειδών κουζίνας.
Χρησιμοποιείται για να διατηρεί καθαρά τα δόντια και το στόμα.
Συμπέρασμα:
Επιπλέον, το τρυγικό οξύ έχει μια σειρά από βιομηχανικές εφαρμογές. Τα μεταλλικά ιόντα, συμπεριλαμβανομένου του ασβεστίου και του μαγνησίου, έχουν αναφερθεί ότι χηλώνονται από το οξύ. Ως αποτέλεσμα, το οξύ έχει χρησιμοποιηθεί ως χηλικός παράγοντας στη γεωργία και στη βιομηχανία μετάλλων για σύμπλοκα μικροθρεπτικά συστατικά σε λιπάσματα εδάφους και για καθαρισμό μεταλλικών επιφανειών από αλουμίνιο, χαλκό, σίδηρο και κράματα αυτών των μετάλλων, αντίστοιχα.




