Ισότοπο
Για να μελετήσουμε σχετικά με την υπερσύζευξη πρέπει να γνωρίζουμε πώς σχηματίζεται η υπερσύζευξη λόγω μετατόπισης ηλεκτρονίων. Τα ηλεκτρόνια συγκεντρώνονται μεταξύ συγκεκριμένων ατόμων σε έναν δεσμό, ωστόσο εάν διπλοί ή απλοί δεσμοί υπάρχουν εναλλάξ σε ένα σύμπλοκο, αυτό ονομάζεται συζευγμένο σύστημα.
Επιδράσεις της μετατόπισης ηλεκτρονίων
Το εφέ επαγωγής
Η πολικότητα παρατηρείται στο άτομο άνθρακα και στην άλλη ομάδα όταν υπάρχει οποιαδήποτε ομάδα απόσυρσης ή απελευθέρωσης ηλεκτρονίων σε μια αλυσίδα άνθρακα. Η μετατόπιση ηλεκτρονίων λόγω διαφορών στις ηλεκτραρνητικότητες προκαλεί μόνιμη πολικότητα. Αυτό είναι γνωστό ως επαγωγικό αποτέλεσμα ή I-effect.
Η ηλεκτραρνητικότητα του υποκαταστάτη καθορίζει το επαγωγικό φαινόμενο. Οι δεσμοί Sigma μεταδίδουν το επαγωγικό αποτέλεσμα, το οποίο εξασθενεί καθώς μεγαλώνει η απόσταση μεταξύ του υποκαταστάτη και του αντιδραστικού κέντρου. Ως αποτέλεσμα, το αποτέλεσμα είναι ισχυρότερο για τον παρακείμενο δεσμό, ο οποίος μπορεί να μείνει ασθενώς πιο μακριά.
Η παρουσία μιας ομάδας απελευθέρωσης ηλεκτρονίων προκαλεί ένα θετικό επαγωγικό αποτέλεσμα. Στην αλυσίδα, αναπτύσσει αρνητικό φορτίο.
Καθώς οι ομάδες απελευθέρωσης ηλεκτρονίων ενισχύουν την πυκνότητα ηλεκτρονίων, η βασική φύση αυξάνεται ενώ η φυσικά όξινη φύση μειώνεται. Ως αποτέλεσμα, οι αλκυλομάδες εξασθενούν τα οξέα.
Σύζυγος
Είναι ένας όρος που χρησιμοποιείται στην οργανική χημεία για να περιγράψει τη διαδικασία ένωσης δύο μορίων μεταξύ τους.
Κανονικά, τα ηλεκτρόνια συγκεντρώνονται μεταξύ συγκεκριμένων ατόμων σε έναν δεσμό, ωστόσο εάν υπάρχουν διπλοί ή απλοί δεσμοί εναλλακτικά σε ένα σύνθετο, ονομάζεται συζευγμένο σύστημα.
Χημεία σύζευξης
Η παρουσία διπλών ή τριπλών δεσμών σε μια οργανική ουσία απαιτείται για τη χημεία σύζευξης.
Τα τροχιακά p που εμπλέκονται στη σύνδεση εντός του συστήματος δεσμών pi είναι η πιο βασική απαίτηση για την ύπαρξη ενός συζευγμένου συστήματος.
Η σύζευξη που σχηματίζεται εκείνη τη στιγμή χάνεται εάν μια θέση στην αλυσίδα εξαιρεί τα τροχιακά p ή εάν η γεωμετρία είναι εκτός ευθυγράμμισης.
Υπερσύζευξη
Σκεφτείτε την περίπτωση όπου μια ομάδα αλκυλίου είναι συνδεδεμένη σε ένα κορεσμένο σύστημα, όπως συζητήθηκε νωρίτερα στο +I αποτέλεσμα. Σε τέτοιες περιπτώσεις, η ομάδα αλκυλίου απελευθερώνει ηλεκτρόνια, αλλά αυτό δεν είναι το ίδιο με το επαγωγικό αποτέλεσμα.
Η υπερσύζευξη είναι η απελευθέρωση ηλεκτρονίων από μια αλκυλομάδα συνδεδεμένη σε μια κορεσμένη ομάδα.
Αν και το άτομο υδρογόνου έχει θετικό φορτίο, δεν υπάρχει σύνδεση μεταξύ αυτού και του ατόμου άνθρακα. Ως αποτέλεσμα, αυτός ο τύπος συντονισμού είναι γνωστός ως συντονισμός χωρίς δεσμό.
Παραδείγματα υπερσύζευξης:
Τουλάχιστον ένα άτομο Η θα πρέπει να υπάρχει στον άνθρακα άλφα.
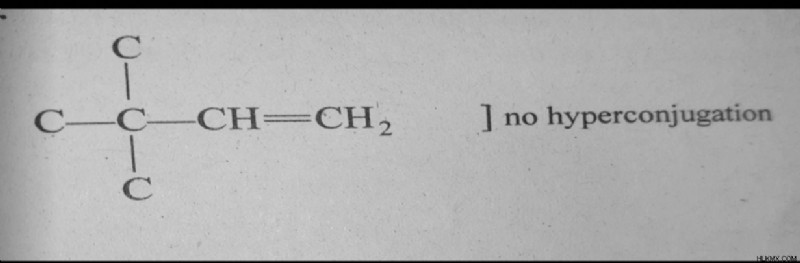
Όσο περισσότεροι δεσμοί C-H υπάρχουν στον άνθρακα άλφα σε ένα ακόρεστο διάλυμα, τόσο περισσότερα ηλεκτρόνια απελευθερώνονται και το φαινόμενο υπερσύζευξης αυξάνεται.

Σχεδιάζοντας τις ακόλουθες δομές υπερσύζευξης του τολουολίου, το αποτέλεσμα δωρεάς ηλεκτρονίων μιας μεθυλομάδας στο τολουόλιο μπορεί επίσης να περιγραφεί με βάση την υπερσύζευξη.
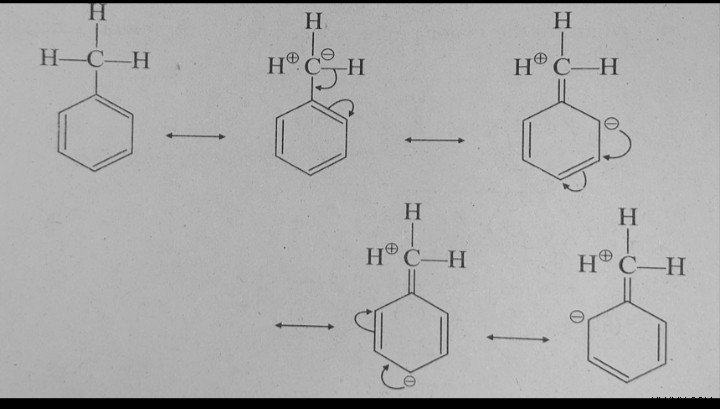
Δομές υπερσύζευξης
Η αλληλεπίδραση υπερσύζευξης είναι εφικτή σε οποιαδήποτε πρωτογενή ρίζα, όπως η ρίζα αιθυλίου, αλλά όχι στην απλή ρίζα μεθυλίου. Ως αποτέλεσμα, η ρίζα αιθυλίου (1°) έχει μεγαλύτερη σταθερότητα από τη ρίζα μεθυλίου. Παρομοίως, η ρίζα 2° αλκυλίου είναι πιο σταθερή από τη ρίζα 1o αλκυλίου, ενώ η ρίζα 3° αλκυλίου είναι πιο σταθερή από τη ρίζα 2° αλκυλίου.
CH 3°> 2°> 1°> CH3
Υπερσύζευξη στο αλκένιο
Αποτοπισμός ηλεκτρονίων, αυτή τη φορά με επικάλυψη μεταξύ ενός τροχιακού pi και ενός τροχιακού σίγμα της ομάδας αλκυλίου, έχει αποδοθεί στον ίδιο υποκείμενο λόγο με τη σταθεροποίηση από έναν δεύτερο διπλό δεσμό:αποτοπισμό ηλεκτρονίων.
Υπερσύζευξη αλκενίου
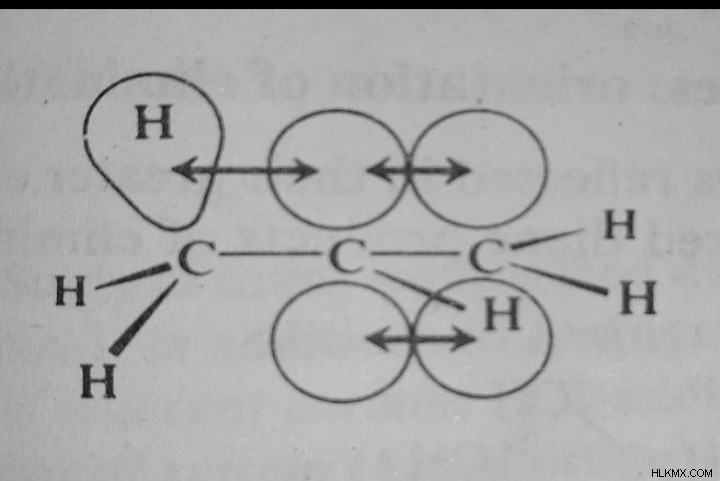
Η υπερσύζευξη σε ένα αλκένιο απεικονίζεται από την επικάλυψη ενός τροχιακού σίγμα και π στο παραπάνω διάγραμμα.
Μεμονωμένα ηλεκτρόνια μπορούν να συνδέσουν τέσσερις πυρήνες μαζί σε κάποιο βαθμό λόγω αυτής της επικάλυψης. Ονομάζουμε αυτόν τον τύπο μετεγκατάστασης, ο οποίος περιλαμβάνει τροχιακό δεσμό σίγμα, υπερσύζευξη.
Αντίστροφη υπερσύζευξη
Ένα σύστημα στο οποίο μια επαφή ηλεκτρονίου κατευθύνεται από τον δεσμό pi στον δεσμό σίγμα αντί από τον δεσμό σίγμα στον δεσμό pi είναι γνωστό ως αντίστροφη υπερσύζευξη ή αρνητική υπερσύζευξη. Με άλλα λόγια, τα ηλεκτρόνια μετατοπίζονται από τον δεσμό pi στον δεσμό σίγμα.
Εφαρμογές υπερσύζευξης
Σταθερότητα αλκενίου:η υπερσύζευξη εξηγεί γιατί ορισμένα αλκένια είναι πιο σταθερά από άλλα. Η σταθερότητα του αλκενίου είναι ανάλογη με τον αριθμό των άλφα υδρογόνων στο μόριο, ο οποίος είναι ανάλογος με τις δομές συντονισμού.
Ο αριθμός των δομών συντονισμού και η ποσότητα των άλφα υδρογόνων είναι ευθέως ανάλογα με τη σταθερότητα των αλκυλοκαρβοκατιόντων.
Το μέγεθος του διπλού δεσμού άνθρακα-άνθρακα σε ένα αλκένιο είναι:Ο χαρακτήρας του απλού δεσμού θα αυξάνεται καθώς αυξάνεται ο αριθμός των συντονιστικών δομών.
Η δύναμη απελευθέρωσης ηλεκτρονίων του R στο αλκυλοβενζόλιο:Το CH3 είναι η ομάδα +R, η οποία χρησιμοποιείται για ηλεκτρόφιλη αρωματική υποκατάσταση λόγω υπερσύζευξης.
Σταθερότητα ελεύθερων ριζών:η υπερσύζευξη εξηγεί τη σταθερότητα των ελεύθερων ριζών.
Συμπέρασμα
Συμπεραίνουμε ότι οι αυξήσεις στην ποσότητα των αλκυλικών υποκαταστατών σε ένα καρβοκατιόν ή ριζικό κέντρο οδηγούν σε αύξηση του σταθερότητα, η οποία εξηγείται από την υπερσύζευξη. Η υπερσύζευξη προκαλείται από δύο βασικούς παράγοντες. Η ύπαρξη ενός ατόμου υδρογόνου σε μια συγκεκριμένη θέση είναι ένα από αυτά, ενώ η παρουσία ενός μόνο ζεύγους ηλεκτρονίων σε μια συγκεκριμένη θέση είναι το άλλο.




