Θειικό οξύ (H2SO4)
Ευρέως γνωστό ως ο βασιλιάς όλων των οξέων, το θειικό οξύ χρησιμοποιείται σε πολλές χημικές αντιδράσεις και βιομηχανικές διεργασίες—καθιστώντας το ένα από τα πιο συχνά χρησιμοποιούμενα οξέα παγκοσμίως. Ως εκ τούτου, η παρασκευή θειικού οξέος είναι πρωταρχικής σημασίας λόγω των υψηλών απαιτήσεων σε κρίσιμες εργαστηριακές εργασίες και βιομηχανικές παραγωγές όπως χαρτιά, υφάσματα και ρεγιόν κ.λπ. Επιπλέον, το θειικό οξύ είναι η ραχοκοκαλιά της βιομηχανίας λιπασμάτων. Η παρασκευή του είναι τόσο απαραίτητη που η ποσότητα του θειικού οξέος μπορεί να καθορίσει τη βιομηχανική ισχύ μιας χώρας! Ας δούμε τι είναι αυτό το εξαιρετικά κρίσιμο οξύ με περισσότερες λεπτομέρειες.
Τι είναι το θειικό οξύ (H2SO4);
Αν και ωφέλιμο, το θειικό οξύ ή το έλαιο βιτριόλης είναι ένα πολύ διαβρωτικό και επικίνδυνο οξύ. Σχηματίζεται από το συνδυασμό τριών στοιχείων θείου, νερού και οξυγόνου με αναλογία 2:1:4. και ο χημικός τύπος του θειικού οξέος είναι H2SO4.
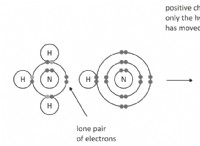
Το καθαρό θειικό οξύ είναι αδύνατο να βρεθεί στη γη, καθώς έχει πολύ υψηλή συγγένεια με τους υδρατμούς και διαλύεται σε αυτόν. Η δομή του θειικού οξέος (H2SO4) περιέχει ένα κεντρικό άτομο θείου που περιβάλλεται από δύο άτομα οξυγόνου και δύο ομάδες υδροξυλίου (ΟΗ).
Μόριο θειικού οξέος (H2SO4)
Το κεντρικό άτομο θείου σχηματίζει διπλούς δεσμούς με κάθε άτομο οξυγόνου και έχει έναν απλό δεσμό με τα δύο οξυγόνα στην ομάδα υδροξυλίου. Το θείο σχηματίζει έξι δεσμούς και έχει τυπικό φορτίο μηδέν.
Τα δύο μεμονωμένα άτομα οξυγόνου συνδέονται με διπλούς δεσμούς, έχουν δύο μονά ζεύγη ηλεκτρονίων το καθένα και τυπικό φορτίο μηδέν. Ομοίως, οι ομάδες υδροξυλίου έχουν τυπικό φορτίο μηδέν και τα οξυγόνα στην ομάδα υδροξυλίου έχουν δύο ζεύγη ηλεκτρονίων το καθένα.
Το θειικό οξύ (H2SO4) είναι ένα άχρωμο και άοσμο οξύ. Είναι γνωστό για τις αφυδατικές του ιδιότητες και χρησιμοποιείται συχνά ως αφυδατικός παράγοντας. Ωστόσο, είναι παχύρρευστο στη φύση και αναμίξιμο με το νερό.
Το θειικό οξύ προστίθεται πάντα στο νερό και όχι το αντίστροφο, καθώς το αντίστροφο απελευθερώνει τεράστια ποσότητα θερμότητας, προκαλώντας βρασμό και πιτσίλισμα του μείγματος.

Χρήσεις θειικού οξέος (H2SO4)
Το θειικό οξύ είναι το πιο παραγόμενο οξύ παγκοσμίως. Έχει τις χρήσεις του σε όλες τις βιομηχανίες που κυμαίνονται από τα λιπάσματα μέχρι την κλωστοϋφαντουργία. Η χρήση του θειικού οξέος (H2SO4) είναι τόσο διαδεδομένη που παίζει ρόλο σε όλα σχεδόν τα βιομηχανικά προϊόντα που βλέπουμε σήμερα. Ρίξτε μια ματιά παρακάτω:
- Το θειικό οξύ χρησιμοποιείται σε λιπάσματα για την αλλαγή του επιπέδου του pH του εδάφους ή ως αφυδατωτικός παράγοντας στο μείγμα.
- Χρησιμοποιείται για την παρασκευή φωσφορικού οξέος.
- Χρησιμοποιείται επίσης για την παρασκευή λιπασμάτων με διόξινο φωσφορικό ασβέστιο και φωσφορικό αμμώνιο.
- Το θειικό οξύ χρησιμοποιείται επίσης για την παρασκευή πολλών χημικών ουσιών όπως υδροχλωρικό οξύ, νιτρικό οξύ, θειικά άλατα κ.λπ.
- Τα συνθετικά απορρυπαντικά κατασκευάζονται επίσης με χρήση θειικού οξέος.
- Διαδραματίζει επίσης σημαντικό ρόλο στην παραγωγή βαφών, εκρηκτικών και ιατρικών φαρμάκων.
- Η διύλιση πετρελαίου χρησιμοποιεί επίσης θειικό οξύ (H2SO4). Χρησιμοποιείται για την απομάκρυνση των ακαθαρσιών που μπορεί να διαλυθούν στη βενζίνη και στα άλλα υποπροϊόντα της.
- Στην κλωστοϋφαντουργία, το ρεγιόν δεν μπορεί να παραχθεί χωρίς θειικό οξύ.
- Οι μπαταρίες που χρησιμοποιούμε σχεδόν όλη την ώρα έχουν θειικό οξύ, το οποίο διευκολύνει την αντίδραση παραγωγής ηλεκτρικής ενέργειας στην μπαταρία.
Πώς παράγεται το θειικό οξύ (H2SO4);
Η καλύτερη μέθοδος στις μέρες μας για την παραγωγή υψηλών συγκεντρώσεων θειικού οξέος είναι η διαδικασία επαφής. Η διαδικασία επαφής είναι μια διαδικασία τεσσάρων σταδίων.
Η διαδικασία ξεκινά με το σχηματισμό διοξειδίου του θείου και τελειώνει με το σχηματισμό θειικού οξέος (H2SO4) με τη διάλυση ελαίου στο νερό:
Σχηματισμός διοξειδίου του θείου
Το διοξείδιο του θείου σχηματίζεται στα επίπεδα της βιομηχανίας με δύο τρόπους:Είτε με θέρμανση καθαρού θείου παρουσία οξυγόνου είτε με ψήσιμο των θειούχων μετάλλων για να ληφθεί διοξείδιο του θείου.
Παραγωγή τριοξειδίου του θείου από διοξείδιο του θείου
Στο δεύτερο στάδιο, το διοξείδιο του θείου αντιδρά με περίσσεια οξυγόνου για να δώσει τριοξείδιο του θείου. Αλλά ο σχηματισμός τριοξειδίου του θείου είναι μια πολύ ευαίσθητη διαδικασία στη θερμοκρασία και την πίεση. Η αντίδραση δίνεται ως:
2SO2 + O2 2SO3
Σχηματισμός ελαίου
Τώρα που σχηματίζεται το τριοξείδιο του θείου, διαλύεται σε θειικό οξύ για να σχηματιστεί ελαίο. Η απευθείας προσθήκη τριοξειδίου του θείου στο νερό αποδίδει επίσης θειικό οξύ (H2SO4), αλλά το αποτέλεσμα είναι εξαιρετικά εξώθερμο. Επομένως, η απευθείας προσθήκη τριοξειδίου του θείου στο νερό παράγει ατμούς οξέος και όχι υγρό θειικό οξύ.
Από την άλλη πλευρά, το ελαιόλαδο μπορεί εύκολα να διαλυθεί στο νερό για να σχηματίσει θειικό οξύ υψηλής συγκέντρωσης. Η αντίδραση δεν είναι εξώθερμη σε σύγκριση με την απευθείας διάλυση του τριοξειδίου του θείου στο νερό και επιτρέπει επίσης μεγαλύτερο έλεγχο της συγκέντρωσης του οξέος που σχηματίζεται.
Η αντίδραση δίνεται ως:
SO3 + H2SO4 → H2S2O7
Διάλυση ελαίου σε νερό
Στη συνέχεια, το έλαιο διαλύεται σε νερό για να δώσει θειικό οξύ (H2SO4). Η αντίδραση δίνεται στη συνέχεια ως:
H2S2O7 + H2O → 2H2SO4
Συμπέρασμα
Το θειικό οξύ είναι ένα διαυγές, λιπαρό υγρό χωρίς χρώμα. διαλύεται στο νερό με εκκένωση θερμότητας. Το οξύ μπορεί να διαβρώσει τόσο μέταλλα όσο και ιστούς. Θα κάψει το ξύλο και τα περισσότερα άλλα οργανικά υλικά σε επαφή, αλλά είναι απίθανο να προκαλέσει φωτιά. Η εισπνοή 15 λιβρών ανά γαλόνι πυκνότητας H2SO4 μπορεί να έχει δυσμενείς επιπτώσεις στην υγεία μετά από μακροχρόνια έκθεση σε χαμηλές δόσεις ή βραχυπρόθεσμη έκθεση σε υψηλές ποσότητες. Χρησιμοποιείται για την κατασκευή λιπασμάτων και άλλων χημικών ουσιών στη διύλιση πετρελαίου, στην κατασκευή σιδήρου και χάλυβα και σε διάφορες άλλες εφαρμογές.