Δεσμός υδρογόνου
Ο δεσμός υδρογόνου αναφέρεται στη διαδικασία σχηματισμού δεσμών υδρογόνου που αποτελούν την ειδική κατηγορία μιας μεγάλης διαμοριακής δύναμης που λαμβάνει χώρα ως αποτέλεσμα της αλληλεπίδρασης μεταξύ του εξαιρετικά ηλεκτραρνητικού ατόμου και του ατόμου υδρογόνου. Για παράδειγμα, το νερό που μπορεί να γραφτεί ως (H2O), το υδρογόνο είναι ομοιοπολικός δεσμός με ηλεκτραρνητικά άτομα. Ως αποτέλεσμα, ο δεσμός υδρογόνου αυξάνεται στα μόρια του νερού λόγω των αλληλεπιδράσεων διπόλου-διπόλου μεταξύ των ατόμων οξυγόνου και των ατόμων υδρογόνου.
Με απλά λόγια, ο δεσμός υδρογόνου είναι ο σχηματισμός δεσμών υδρογόνου. Σήμερα, θα μάθουμε λεπτομερώς για τους δεσμούς υδρογόνου μαζί με τα σχετικά θέματα.
Εξηγήστε τους δεσμούς υδρογόνου
Ο δεσμός υδρογόνου συμβαίνει κυρίως μεταξύ ενός ηλεκτραρνητικού και ενός ατόμου υδρογόνου. Μερικά από τα κοινά ηλεκτραρνητικά άτομα είναι το φθόριο, το χλώριο και το οξυγόνο. Σε σύγκριση με τον ιοντικό ή ομοιοπολικό δεσμό, ο δεσμός υδρογόνου είναι γενικά πιο αδύναμος. Από την άλλη πλευρά, πιστεύεται ότι είναι πολύ ισχυρότερο από τις δυνάμεις van der Waals. Περαιτέρω, οι δεσμοί υδρογόνου ταξινομούνται στην κατηγορία των αδύναμων χημικών δεσμών.
Παραδείγματα δεσμών υδρογόνου
Ακολουθούν ορισμένα κοινά παραδείγματα δεσμών υδρογόνου –
Δεσμός υδρογόνου στο υδροφθόριο
Δεδομένου ότι το φθόριο έχει την υψηλότερη τιμή ηλεκτραρνητικότητας, οδηγεί στο σχηματισμό του ισχυρότερου δεσμού υδρογόνου.
H−F···H−F···H−F
Δεσμός υδρογόνου στο νερό
Ένα μόριο νερού έχει ένα εξαιρετικά ηλεκτραρνητικό άτομο οξυγόνου συνδεδεμένο με άτομα υδρογόνου. Εφόσον το άτομο οξυγόνου έλκει το κοινό ζεύγος του ηλεκτρονίου, το άκρο του γίνεται αρνητικό, ενώ το άτομο υδρογόνου γίνεται θετικό.

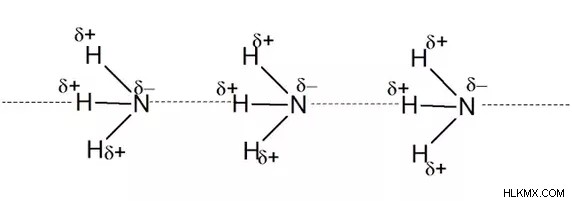
Δεσμός υδρογόνου στην αμμωνία
Έχει άζωτο ηλεκτραρνητικού ατόμου συνδεδεμένο με άτομα υδρογόνου.
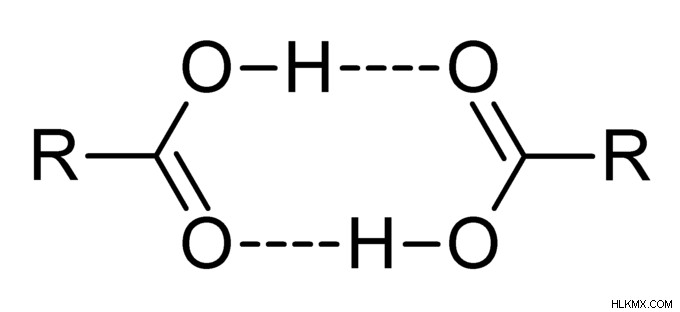
Δεσμός υδρογόνου σε καρβοξυλικό οξύ και αλκοόλες
Το αλκοόλ μπορεί να περιγραφεί ως το οργανικό μόριο που έχει μια ομάδα -ΟΗ.
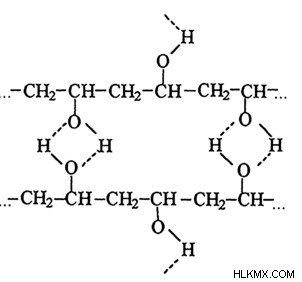
Δεσμός υδρογόνου στο πολυμερές
Προκειμένου να προσδιοριστούν οι τρισδιάστατες δομές και οι ιδιότητες που αποκτώνται από φυσικές και συνθετικές πρωτεΐνες, ο δεσμός υδρογόνου είναι ένας κρίσιμος παράγοντας. Παίζει επίσης σημαντικό ρόλο στον καθορισμό της δομής της κυτταρίνης μαζί με τα παράγωγα πολυμερή, συμπεριλαμβανομένου του λιναριού ή του βαμβακιού.
Τύποι δεσμών υδρογόνου
Υπάρχουν κυρίως δύο σημαντικοί τύποι δεσμών υδρογόνου (Η). Εδώ είναι –
Δεσμός διαμοριακού υδρογόνου
Σε περίπτωση που λαμβάνει χώρα δεσμός υδρογόνου μεταξύ μορίων που έχουν είτε τις ίδιες είτε διαφορετικές ενώσεις, αυτές αναφέρονται ως διαμοριακός δεσμός υδρογόνου. Συνήθη παραδείγματα διαμοριακών δεσμών υδρογόνου περιλαμβάνουν δεσμούς υδρογόνου σε νερό, αλκοόλη, αμμωνία και ούτω καθεξής.
Ενδομοριακός δεσμός υδρογόνου
Ο ενδομοριακός δεσμός υδρογόνου αναφέρεται στον δεσμό υδρογόνου που συμβαίνει κυρίως στο ίδιο το μόριο. Αυτός ο τύπος δεσμού υδρογόνου λαμβάνει χώρα σε ενώσεις που έχουν δύο ομάδες. Από τις δύο ομάδες, μια ομάδα έχει άτομο υδρογόνου, ενώ μια άλλη ομάδα έχει το εξαιρετικά ηλεκτραρνητικό άτομο.
Ιδιότητες σύνδεσης υδρογόνου
Ακολουθούν οι ιδιότητες του δεσμού υδρογόνου –
Πτητικότητα – Εφόσον οι ενώσεις με υδρογόνο που συνδέονται μεταξύ πολλών διαφορετικών μορίων έχουν υψηλότερο σημείο βρασμού, είναι συγκριτικά λιγότερο πτητικές.
Επιφανειακή τάση και ιξώδες – Οι ουσίες που έχουν δεσμούς υδρογόνου υπάρχουν ως το συσχετισμένο μόριο. Επομένως, η ροή τους είναι πολύ δύσκολη. Ωστόσο, έχουν περισσότερο ιξώδες και επιφανειακή τάση.
Διαλυτότητα – Δεδομένου ότι ο δεσμός υδρογόνου μπορεί να λάβει χώρα μεταξύ μορίων αλκοόλης και νερού, η αλκοόλη είναι πιο διαλυτή στο νερό.
Χαμηλότερη πυκνότητα πάγου σε σύγκριση με το νερό. – Όταν μιλάμε για τον πάγο, ο δεσμός υδρογόνου οδηγεί στη δομή που μοιάζει με κλουβί. Ωστόσο, κάθε μόριο νερού είναι στενά συνδεδεμένο με τα τέσσερα μόρια του νερού. Δεδομένου ότι τα μόρια βρίσκονται στην υγρή τους κατάσταση, δεν είναι συσκευασμένα στενά. Καθώς ο πάγος αρχίζει να λιώνει, η δομή που μοιάζει με θήκη αρχίζει επίσης να λιώνει και όλα τα μόρια έρχονται πιο κοντά το ένα στο άλλο. Ως αποτέλεσμα, ακόμη και αν η μάζα του νερού είναι ίδια, η πυκνότητα αυξάνεται και ο όγκος μειώνεται.
Συνθήκες για τον δεσμό υδρογόνου
Όταν σε ένα μόριο, όλα τα άτομα υδρογόνου συνδέονται στενά με όλα τα ηλεκτραρνητικά άτομα. Επομένως, το άκρο του μορίου γίνεται αρνητικό, ωστόσο, το άλλο άκρο παραμένει θετικό. Εξαιτίας αυτού, και οι δύο πλευρές άρχισαν να έλκονται σε ένα άλλο οδηγώντας σε έναν εύκολο σχηματισμό ενός ασθενούς δεσμού που ονομάζεται δεσμός υδρογόνου.
Συμπέρασμα
Ο δεσμός υδρογόνου αναφέρεται στη διαδικασία σχηματισμού δεσμών υδρογόνου που αποτελούν την ειδική κατηγορία μιας μεγάλης διαμοριακής δύναμης που λαμβάνει χώρα ως αποτέλεσμα της αλληλεπίδρασης μεταξύ του εξαιρετικά ηλεκτραρνητικού ατόμου και του ατόμου υδρογόνου.
Οι ειδικοί ταξινόμησαν τους δεσμούς υδρογόνου ως έναν τύπο αδύναμου χημικού δεσμού. Μερικά από τα κοινά παραδείγματα δεσμών υδρογόνου είναι ο δεσμός υδρογόνου στο υδροφθόριο, ο δεσμός υδρογόνου στο νερό, ο δεσμός υδρογόνου στην αμμωνία, ο δεσμός υδρογόνου στο πολυμερές και ούτω καθεξής, τα οποία συζητήσαμε λεπτομερώς. Περαιτέρω ταξινομείται σε δύο κύρια μέρη, συμπεριλαμβανομένων των Διαμοριακών και Ενδομοριακών Δεσμών Υδρογόνου. Στο τελευταίο μέρος, συζητήσαμε επίσης τις ιδιότητες και τις συνθήκες του δεσμού υδρογόνου.




