Δεσμός υδρογόνου στην αμμωνία
Με απλά λόγια, ο δεσμός υδρογόνου είναι ο σχηματισμός δεσμών υδρογόνου. Εμφανίζεται κυρίως μεταξύ ενός ηλεκτραρνητικού και ενός ατόμου υδρογόνου. Μερικά από τα κοινά ηλεκτραρνητικά άτομα είναι το φθόριο, το χλώριο και το οξυγόνο. Σε σύγκριση με τον ομοιοπολικό ή ιοντικό δεσμό, ο δεσμός υδρογόνου είναι γενικά πιο αδύναμος. Ωστόσο, είναι ισχυρότερο από τις δυνάμεις van der Waals. Οι ειδικοί ταξινόμησαν τους δεσμούς υδρογόνου ως έναν τύπο αδύναμου χημικού δεσμού.
Σήμερα, σχετικά με το θέμα των δεσμών υδρογόνου στην αμμωνία, θα μάθουμε για τους δεσμούς υδρογόνου και τους δεσμούς υδρογόνου στη σημασία της αμμωνίας μαζί με σχετικά θέματα λεπτομερώς.
Δεσμός υδρογόνου
Ο δεσμός υδρογόνου μπορεί να περιγραφεί ως η διαδικασία σχηματισμού δεσμών υδρογόνου που αποτελούν ειδική κατηγορία ελκτικής διαμοριακής δύναμης, η οποία προκύπτει λόγω της αλληλεπίδρασης διπόλου-διπόλου μεταξύ του ατόμου υδρογόνου και του εξαιρετικά ηλεκτραρνητικού ατόμου. Για παράδειγμα, στην περίπτωση των μορίων του νερού, που χημικά σημειώνονται ως H2O, το υδρογόνο συνδέεται ομοιοπολικά με το ηλεκτραρνητικό άτομο οξυγόνου.
Σαν αποτέλεσμα, ο δεσμός υδρογόνου αυξάνεται στα μόρια του νερού λόγω των αλληλεπιδράσεων διπόλου-διπόλου μεταξύ των ατόμων οξυγόνου και των ατόμων υδρογόνου. Σύμφωνα με τους ειδικούς, ο δεσμός υδρογόνου είναι ως επί το πλείστον ισχυρός σε σύγκριση με τις κανονικές δυνάμεις διασποράς και διπόλου-διπόλου. Ωστόσο, φαίνεται να είναι αδύναμο αν συγκριθεί με ιοντικούς δεσμούς ή αληθινούς ομοιοπολικούς δεσμούς. Επιπλέον, ο δεσμός υδρογόνου χωρίζεται σε δύο κύρια μέρη. Αυτά περιλαμβάνουν-
Ο διαμοριακός δεσμός υδρογόνου είναι ένας τύπος δεσμού υδρογόνου όπου λαμβάνει χώρα μεταξύ διαφορετικών μορίων που έχουν είτε τις ίδιες είτε διαφορετικές ενώσεις.
Ο ενδομοριακός δεσμός υδρογόνου είναι ένας άλλος τύπος δεσμού υδρογόνου που εμφανίζεται κυρίως μόνο εντός του μορίου. Αυτός ο τύπος δεσμού υδρογόνου λαμβάνει χώρα σε ενώσεις που έχουν δύο ομάδες.
Αμμωνία
Ο χημικός τύπος της αμμωνίας είναι NH3. Είναι μια ένωση υδρογόνου και αζώτου. Η αμμωνία είναι ένα αέριο που δεν έχει χρώμα και έχει μια ξεχωριστή πικάντικη μυρωδιά. Η αμμωνία είναι ένα αζωτούχο απόβλητο που απελευθερώνεται περισσότερο από τους υδρόβιους οργανισμούς. Καλύπτει τις διατροφικές ανάγκες των χερσαίων οργανισμών. Η αμμωνία χρησιμεύει ως πρόδρομος για το 45% των παγκόσμιων λιπασμάτων και τροφίμων. Η αμμωνία χρησιμοποιείται για τη σύνθεση πολλών φαρμακευτικών προϊόντων. Η αμμωνία χρησιμοποιείται επίσης σε εμπορικά προϊόντα καθαρισμού.
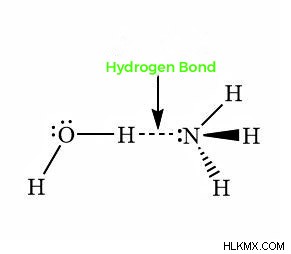
Δεσμός υδρογόνου στην αμμωνία
Στην αμμωνία, που χημικά αντιπροσωπεύεται ως NH3), ο συνολικός αριθμός των δεσμών υδρογόνου είναι περιορισμένος καθώς κάθε άζωτο έχει μόνο ένα ζεύγος ηλεκτρονίων κοινό με το μεμονωμένο υδρογόνο. Στην ομάδα μορίων αμμωνίας, το μοναχικό ζεύγος ηλεκτρονίων δεν επαρκεί για το σχηματισμό του δεσμού υδρογόνου. Η αμμωνία έχει άζωτο ηλεκτραρνητικού ατόμου συνδεδεμένο με άτομα υδρογόνου.
Παρασκευή αμμωνίας
Η αμμωνία βρίσκεται στο έδαφος και στον αέρα λόγω της αποσύνθεσης των οργανισμών. Η αμμωνία του εδάφους είναι αζωτούχου χαρακτήρα.
Για την παραγωγή αμμωνίας σε μικρή ποσότητα το άλας αμμωνίου αντιδρά με καυστική σόδα –
2NH4Cl + Ca (OH)2 → 2NH3 + 2H2O + CaCl2
Για την παραγωγή αμμωνίας σε μεγάλες ποσότητες, χρησιμοποιείται η διαδικασία Haber.
N2 (g) + 3H2 (g) ↔ 2NH3 (g)
Για την αντίδραση, το άζωτο και το υδρογόνο λαμβάνονται ως πρώτες ύλες. Με το τρίψιμο αφαιρούνται οι ακαθαρσίες από τα αέρια.
Το ακατέργαστο άζωτο και το υδρογόνο συγχωνεύονται μαζί. Μετά από αυτό, συμπιέζεται σε συμπιεστή σε πίεση 200 atm.
Στη συνέχεια, το μείγμα θερμαίνεται στους 450 βαθμούς Κελσίου σε μετατροπέα στις 200 atm.
Το μείγμα υδρογόνου, αμμωνίας και αζώτου συλλέγεται από τον μετατροπέα.
Το μείγμα ψύχεται και συλλέγεται σε μια δεξαμενή σε υγρή μορφή.
Ιδιότητες της αμμωνίας
Ακολουθούν οι ιδιότητες της αμμωνίας –
Φυσικές ιδιότητες
Η αμμωνία είναι ένα άχρωμο αέριο με ξεχωριστή πικάντικη οσμή. Η αμμωνία έχει γεύση σαπουνιού. Η αμμωνία είναι ένα πολύ ελαφρύ αέριο περισσότερο από τον αέρα. Η αμμωνία διαλύεται στο νερό πολύ γρήγορα. Η αμμωνία λιώνει σε θερμοκρασία δωματίου.
Χημικές ιδιότητες
Ακολουθούν οι χημικές ιδιότητες –
Εύφλεκτο – Στον αέρα, είναι εύφλεκτο.
Θερμική σταθερότητα – Η αμμωνία είναι αδρανής. Μπορούμε να διασπάσουμε την αμμωνία σε άζωτο και υδρογόνο προχωρώντας σε μεταλλικές ορμές που έχουν θερμανθεί.
Βασικός χαρακτήρας – Η ένωση έχει την τάση να παρέχει το μοναδικό της ζεύγος ηλεκτρονίων αζώτου σε άλλα διαφορετικά άτομα. Η αμμωνία δρα ως ισχυρή βάση Lewis.
Δομή της αμμωνίας
Ο χημικός τύπος της αμμωνίας είναι NH3 και το μοριακό της βάρος είναι 17,031 g/mol. Υπάρχουν απλοί δεσμοί μεταξύ των ατόμων αζώτου και τριών ατόμων υδρογόνου. Η πυκνότητα της αμμωνίας είναι 0,73 kg/m³. Το σημείο τήξης της αμμωνίας είναι -77,73 °C. Το σημείο βρασμού της αμμωνίας είναι -33,34 °C.
Χρήσεις αμμωνίας
Χρησιμοποιείται για την παραγωγή ανθρακικού νατρίου.
Χρησιμοποιείται για την παραγωγή νιτρικού οξέος.
Χρησιμοποιείται για την παραγωγή κομπόστ, για παράδειγμα, νιτρικό αμμώνιο, θειικό αμμώνιο, φωσφορικό διαμμώνιο ουρίας.
Στα φυτά πάγου, η αμμωνία χρησιμοποιείται ως ψυκτικό μέσο. Συχνότερα, το χρησιμοποιούμε και ως ψυκτικό μέσο.
Η αμμωνία χρησιμοποιείται ως χειριστής καθαρισμού για γυάλινες επιφάνειες και έπιπλα στη βιομηχανία επίπλων.
Συμπέρασμα
Η αμμωνία είναι ένα αέριο που παράγεται από υδρογόνο και οξυγόνο και είναι απαραίτητο για τα φυτά και τα ζώα. Το νιτρικό οξύ είναι ένα πολύ διαβρωτικό ορυκτό οξύ. Η αμμωνία είναι ένα άχρωμο αέριο με ξεχωριστή πικάντικη οσμή. Ο χημικός τύπος της αμμωνίας είναι NH3 και το μοριακό της βάρος είναι 17,031 g/mol.
Η αμμωνία παρασκευάζεται με πολλές μεθόδους. ένα από αυτά είναι η διαδικασία του Haber. Χρησιμοποιείται για την παραγωγή ανθρακικού νατρίου, νιτρικού οξέος και ούτω καθεξής. Η αμμωνία έχει άζωτο ηλεκτραρνητικού ατόμου συνδεδεμένο με άτομα υδρογόνου. Τελειώσαμε το θέμα με διάφορες χρήσεις της αμμωνίας και των δεσμών υδρογόνου στη σημασία της αμμωνίας.




