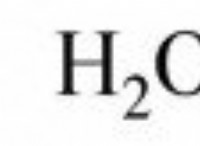Αντιδράσεις πρώτης τάξης
Η χημεία, από τη φύση της, έχει να κάνει με διαφορετικές αντιδράσεις και αλλαγές. Στη χημεία συμβαίνουν διάφορες χημικές αντιδράσεις, οι οποίες μελετώνται με τη βοήθεια του κλάδου της που ονομάζεται Χημική Κινητική. Η λέξη κινητική προέρχεται από την ελληνική λέξη «kinesis» που σημαίνει κίνηση. Η χημική κινητική έχει να κάνει με τον ρυθμό των αντιδράσεων και την ταχύτητα των αντιδράσεων. Ο ρυθμός της αντίδρασης γενικά εκφράζεται ως μείωση των αντιδρώντων και αύξηση της συγκέντρωσης των προϊόντων. Οι συγκεντρώσεις λαμβάνονται σε gm-moles/λίτρο, επομένως ο ρυθμός είναι moles/λίτρο/δευτερόλεπτο. Οι τύποι τάξεων που έχουν οι χημικές κινητικές είναι:- αντίδραση μηδενικής τάξης, αντίδραση πρώτης τάξης, αντίδραση δεύτερης τάξης ή μικτή τάξη.
Στις αντιδράσεις πρώτης τάξης, ο ρυθμός εξαρτάται από την πρώτη ισχύ συγκέντρωσης ενός μεμονωμένου αντιδραστηρίου. Μια αντίδραση πρώτης τάξης αντιπροσωπεύεται από:
A → B
t=0 C0 –
t=t C x
όπου Α είναι το αντιδρόν και Β είναι το προϊόν. Σε αντιδράσεις πρώτης τάξης, ο ρυθμός αντίδρασης είναι ευθέως ανάλογος με τη συγκέντρωση ενός από τα αντιδρώντα. Η διαφορική εξίσωση για αντίδραση πρώτης τάξης ή η εξίσωση αντίδρασης πρώτης τάξης είναι:
–dcdt=KC
όπου "c" είναι η συγκέντρωση του αντιδρώντος ανά πάσα στιγμή "t" και k είναι η σταθερά ταχύτητας ή η αντίδραση ειδικής ταχύτητας
Αν η συγκέντρωση του c διπλασιαστεί, ο ρυθμός αντίδρασης διπλασιάζεται επίσης. Εάν η συγκέντρωση του c αυξηθεί κατά τον παράγοντα 10 ή άλλο, ο ρυθμός της αντίδρασης αυξάνεται επίσης κατά τον παράγοντα 10 ή τον άλλο. Επειδή οι μονάδες του ρυθμού αντίδρασης είναι πάντα moles ανά λίτρο ανά δευτερόλεπτο. Οι αντιδράσεις πρώτης τάξης εξαρτώνται μόνο από τη συγκέντρωση ενός αντιδραστηρίου.
Χρόνος ημιζωής αντιδράσεων πρώτης τάξης
Ο χρόνος ημιζωής οποιασδήποτε αντίδρασης ορίζεται ως ο χρόνος που χρειάζεται η αντιδρών για τη μείωση της συγκέντρωσής του στο μισό της αρχικής του συγκέντρωσης. Επομένως [C]o=[C]/2.
Για να προσδιορίσουμε τον χρόνο ημιζωής μιας αντίδρασης, πρέπει να γνωρίζουμε τα εξής:
Σειρά της αντίδρασης
Βαθμολογήστε τη σταθερά K ή οποιαδήποτε πληροφορία για τον προσδιορισμό της
Αν δύο αντιδράσεις έχουν την ίδια σειρά, τότε
Ο χρόνος ημιζωής θα είναι μεγαλύτερος για την βραδύτερη αντίδραση δύο αντιδράσεων που έχουν την ίδια σειρά ή ο χρόνος ημιζωής θα είναι μικρότερος για την ταχύτερη αντίδραση δύο αντιδράσεων με την ίδια σειρά.
Ο χρόνος ημιζωής της αντίδρασης πρώτης τάξης είναι σταθερός υπό ένα δεδομένο σύνολο συνθηκών αντίδρασης. Αυτό δεν ισχύει για αντιδράσεις δεύτερης και μηδενικής τάξης. Η συγκέντρωση του αντιδρώντος είναι ανεξάρτητη από τον χρόνο ημιζωής της αντίδρασης πρώτης τάξης. Επομένως, ο χρόνος ημιζωής της αντίδρασης πρώτης τάξης είναι
ln2k=0,693k.
Ψευδικές αντιδράσεις πρώτης τάξης
Μια ψευδο-αντίδραση πρώτης τάξης είναι μια αντίδραση δεύτερης τάξης ή διμοριακή, η οποία προετοιμάζεται ή γίνεται να συμπεριφέρεται σαν αντίδραση πρώτης τάξης. Αυτή η αντίδραση συμβαίνει όταν το αντιδρών είναι σε περίσσεια ή διατηρείται σε συγκέντρωση σε σύγκριση με την άλλη ουσία, ένα από τα αντιδρώντα είναι ο καταλύτης. Παραδείγματα ψευδο αντιδράσεων πρώτης τάξης είναι:
Ενυδάτωση αλκυλαλογονιδίου
CH3I (aq) + H2O (l) →CH3OH (aq) + H+ (aq) + I – (aq)
Υδρόλυση ζάχαρης από ζαχαροκάλαμο
C12H22O11 + H2O → C6H12O6 + C6H12O
Υδρόλυση εστέρα
CH3COOC2H5 + H2O → CH3COOH + C2H5OH
Υδρόλυση οξικού αιθυλεστέρα
CH3COOC2H5 + H2O → CH3COOH + C2H5OH
Το αντιδρών στις αντιδράσεις ψευδο-πρώτης τάξης πρέπει να απομονώνεται.
Μονάδα σταθεράς ταχύτητας για αντιδράσεις πρώτης τάξης
Στη Χημική κινητική η σταθερά ταχύτητας ορίζεται ως η σταθερά αναλογικότητας, η οποία εξηγεί τον ρυθμό αντίδρασης και τη σχέση μεταξύ της μοριακής συγκέντρωσης των αντιδρώντων. Οι σταθερές ταχύτητας είναι ειδικές για μια συγκεκριμένη αντίδραση. Μετρώνται από τη συγκέντρωση των ειδών με την πάροδο του χρόνου στο εργαστήριο. Ο ρυθμός αντίδρασης είναι η αλλαγή στη συγκέντρωση με το χρόνο.
Ρυθμός αντίδρασης=mol/liter/sec
Τιμή =k[A]
Όπου k είναι σταθερά ρυθμού
mol/lit/sec =k(mol/lit)
k=1/sec
Επομένως, η μονάδα της σταθεράς ταχύτητας για αντιδράσεις πρώτης τάξης είναι 1/sec ή s-1.
Παραδείγματα αντιδράσεων πρώτης τάξης
Οι εξισώσεις αντίδρασης πρώτης τάξης είναι πολύ συνηθισμένες. Ακολουθούν μερικά παραδείγματα αντιδράσεων πρώτης τάξης:-
- Όταν το τριμεθυλοβρωμομεθάνιο αντιδρά με υδροξείδιο του νατρίου, δίνει τριμεθυλομεθανόλη και βρωμιούχο νάτριο.
(CH3)3CBr + NaOH → (CH3)3COH + NaBr
Η αποσύνθεση του υπεροξειδίου του υδρογόνου δίνει νερό και οξυγόνο.
2H2O2 → H2O + O2
Υδρόλυση οξικού μεθυλεστέρα παρουσία ανόργανων οξέων
CH3COOCH3 + H2O → CH3COOH + CH3OH
Υδρογόνωση του αιθενίου.
C2H4 + H2 → C2H6 (g)
Αποσύνθεση νιτρικού αμμωνίου παρουσία υδατικού διαλύματος.
NH4NO2 (aq.) → N2 + 2H2O
Συμπέρασμα
Ο τύπος αντίδρασης πρώτης τάξης είναι -d[A]/dT =k[A]1
– Όπου k είναι η σταθερά ρυθμού της οποίας η μονάδα είναι αντίστροφη δευτερόλεπτο.
– Το [A] είναι η συγκέντρωση του αντιδραστηρίου πρώτης τάξης "A".
– d[A]/dt υποδηλώνει τη μεταβολή της συγκέντρωσης του αντιδραστηρίου πρώτης τάξης «A» στο χρονικό διάστημα «dt».
Η σειρά της αντίδρασης πρώτης τάξης είναι ίση με 1(ένα). Η κύρια διαφορά μεταξύ αντιδράσεων πρώτης τάξης και αντιδράσεων άλλης τάξης είναι ότι για κινητικές πρώτης τάξης μπορούμε να γράψουμε τάξη ισοδύναμη με το άθροισμα του Στοιχειομετρικού Συντελεστή, αλλά αυτό δεν ισχύει για άλλη τάξη. Η εξίσωση αντίδρασης πρώτης τάξης είναι – dA/dt=kA.