Εξισορρόπηση Χημικών Εξισώσεων
Τι είναι η χημική εξίσωση;
Μια χημική εξίσωση αντιπροσωπεύει μια χημική αντίδραση χρησιμοποιώντας σύμβολα και αριθμούς. Οι χημικές εξισώσεις δείχνουν τις σχετικές μοριακές ποσότητες και ταυτότητες διαφορετικών αντιδραστηρίων και προϊόντων. Η εξισορρόπηση των χημικών εξισώσεων μπορεί να σας βοηθήσει να προσδιορίσετε την ακριβή αναλογία των ενώσεων που εμπλέκονται σε μια αντίδραση!
Βασικές αρχές μιας χημικής εξίσωσης
1. Βασικά μέρη μιας χημικής εξίσωσης
Υπάρχουν 3 βασικά μέρη σε μια χημική εξίσωση:αντιδρώντα, προϊόντα και το βέλος "αποδόσεις".
| Αντιδρώντα | Αποδόσεις | Προϊόντα | |
| Ορισμός | Τα αντιδρώντα είναι ενώσεις ή στοιχεία που χρειάζονται στην αντίδραση και που υφίστανται χημική αλλαγή κατά τη διάρκεια της αντίδρασης. | Στις αντιδράσεις, η "απόδοση" σημαίνει "παράγω" ή "σχηματίζω" και συνήθως αναπαρίσταται με ένα βέλος. Όταν τα αντιδρώντα υφίστανται μια χημική αλλαγή, αποδίδουν προϊόντα. | Τα προϊόντα είναι τα τελικά αποτελέσματα ή ενώσεις που παράγονται σε μια χημική αντίδραση. |
| Παράδειγμα | CH4 (ζ) + 2O2 (ζ) | → | CO2 (ζ) + 2Η2 O (g) |
Τα αντιδρώντα και τα προϊόντα παρατίθενται ως πολλαπλά μόρια που προστίθενται μαζί, και αυτό ισχύει για οποιαδήποτε χημική εξίσωση. Το βέλος απόδοσης, ωστόσο, μπορεί να έρθει σε μερικά διαφορετικά στυλ:
- Το βέλος προς τα εμπρός (→) δείχνει μια γενική αντίδραση.
- Το βέλος ισορροπίας (⇌) δείχνει μια αναστρέψιμη διαδικασία.
- Το βέλος συντονισμού (↔) δείχνει ότι δύο ή περισσότερα είδη είναι δομές συντονισμού μεταξύ τους.
- Το θεωρητικό βέλος (⇢) δείχνει μια θεωρητική διαδικασία.
- Το ρετροσυνθετικό βέλος (⇒) δείχνει πιθανούς τρόπους μετάβασης από τα αντιδρώντα σε προϊόντα.
2. Οι αριθμοί στις χημικές εξισώσεις
Υπάρχουν δύο τύποι αριθμών στις χημικές εξισώσεις:οι δείκτες και οι συντελεστές. Συνδρομές αντιπροσωπεύουν πόσα άτομα κάθε στοιχείου υπάρχουν σε ένα μόριο. Συντελεστές αντιπροσωπεύουν πόσα μόρια μιας συγκεκριμένης χημικής ένωσης υπάρχουν στην αντίδραση. Μόνο οι συντελεστές μορίων μπορούν να αλλάξουν στις εξισώσεις εξισορρόπησης.
Μόρια στα οποία τα υπογράφονται των ατόμων των ίδιων στοιχείων είναι διαφορετικά (για παράδειγμα H2 O έναντι H2 O2 ) έχουν διαφορετικές χημικές συνθέσεις, που σημαίνει ότι δεν είναι η ίδια ένωση. Για αυτόν τον λόγο, κατά την εξισορρόπηση χημικών εξισώσεων, οι δείκτες των μορίων δεν μπορούν να αλλάξουν. Τα ίδια μόρια έχουν διαφορετικούς συντελεστές (για παράδειγμα 2H2 O και 5H2 Ο) είναι οι ίδιες ενώσεις, υπάρχουν σε διαφορετικές ποσότητες.
Σε ένα μόριο 3NO2 , ο συντελεστής είναι 3 (υπάρχουν 3 μόρια NO2 ), και ο δείκτης του οξυγόνου είναι 2 (υπάρχουν 2 άτομα οξυγόνου σε 1 μόριο NO2 ). Συνολικά, υπάρχουν 6 άτομα οξυγόνου (3 μόρια NO2 και 2 άτομα οξυγόνου ανά 1 μόριο NO2 .)
Οι συντελεστές κάθε μορίου ή ένωσης αντιπροσωπεύουν τη σχετική ποσότητα του στοιχείου στην αντίδραση σε mol ή αριθμούς μορίων. Επειδή είναι σχετικές ποσότητες, οι αριθμοί μπορούν επίσης να ερμηνευθούν ως αναλογίες. στο παραπάνω παράδειγμα, η αναλογία θα ήταν 1 CH4 :2O2 :1 CO2 :2H2 Ο. Εφόσον οι λόγοι είναι σταθεροί, η εξίσωση μπορεί να ξαναγραφεί σωστά με οποιουσδήποτε αναλογικούς συντελεστές (όπως 2:4:2:4, 3:6:3:6, κ.λπ.), αν και είναι κοινή πρακτική να χρησιμοποιείται τους μικρότερους ακέραιους συντελεστές .
3. Ο νόμος της διατήρησης της μάζας
Ο νόμος της διατήρησης της μάζας δηλώνει ότι η ύλη (ή τα άτομα) ούτε δημιουργούνται ούτε καταστρέφονται σε χημικές αντιδράσεις. Αυτό σημαίνει ότι πρέπει να υπάρχουν ίσες ποσότητες από κάθε ένωση πριν και μετά την πραγματοποίηση μιας χημικής αντίδρασης. Ο νόμος ισχύει για τις χημικές εξισώσεις εξισορρόπησης επειδή πρέπει να υπάρχουν οι ίδιες σχετικές ποσότητες κάθε ένωσης και στις δύο πλευρές της εξίσωσης.
Ακολουθεί ένα παράδειγμα αντίδρασης κατά την οποία το μεθάνιο καίγεται στον αέρα για να παράγει διοξείδιο του άνθρακα και υδρατμούς:
CH4 (ζ) + 2O2 (ζ) → CO2 (ζ) + 2Η2 O (g)
Όπως μπορείτε να δείτε, και οι δύο πλευρές της εξίσωσης έχουν 1 άτομο άνθρακα, 4 άτομα υδρογόνου και 4 άτομα οξυγόνου. Έτσι η εξίσωση είναι ισορροπημένη.
Βήματα για τη σύνταξη και την εξισορρόπηση χημικών εξισώσεων
- Προσδιορίστε τα ονόματα των αντιδρώντων και των προϊόντων. Μπορεί να είναι χρήσιμο να γράψετε μια εξίσωση λέξης να απαριθμήσει όλες τις ενώσεις της αντίδρασης. Σε μια εξίσωση λέξεων, τα αντιδρώντα και τα προϊόντα αντιπροσωπεύονται από τα ονόματά τους, που σημαίνει ότι γράφονται σε μορφή λέξης, αντί ως μοριακός τύπος.
- Είναι σημαντικό να θυμάστε ότι οι εξισώσεις λέξεων δείχνουν μόνο τα ονόματα των ενώσεων και όχι τις ποσότητες. Αυτό σημαίνει ότι οι εξισώσεις λέξεων δεν δείχνουν την πλήρη εικόνα της αντίδρασης.
- Χρησιμοποιώντας τη λέξη εξίσωση, γράψτε μια εξίσωση τύπου ξαναγράφοντας όλες τις ενώσεις στον χημικό τους τύπο.
- Οι εξισώσεις τύπου δεν είναι ισορροπημένες . Δείχνουν τις ενώσεις μόνο στον χημικό τους τύπο.
- Ισορροπήστε την εξίσωση του τύπου χρησιμοποιώντας το νόμο της διατήρησης της μάζας για να γράψετε τη χημική εξίσωση.
- Ξεκινήστε μετρώντας τα άτομα των στοιχείων που εμφανίζονται μόνο μία φορά σε κάθε πλευρά της εξίσωσης και εξισορροπήστε πρώτα αυτά. Ισορροπήστε τα άτομα που εμφανίζονται πολλές φορές σε κάθε πλευρά της εξίσωσης τελευταία.
- Συνήθως, ισορροπήστε τυχόν άτομα υδρογόνου ή οξυγόνου.
- Μετά την εξισορρόπηση όλων των ατόμων, έχετε μια ισορροπημένη εξίσωση τύπου ή χημική εξίσωση .
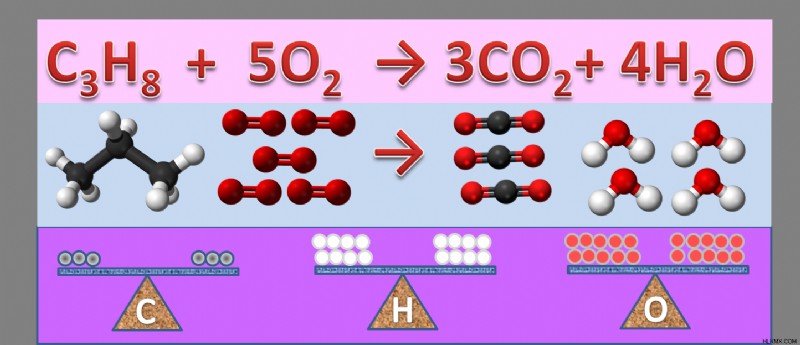
Χημικές εξισώσεις εξισορρόπησης – Παράδειγμα
Ισορροπήστε την αντίδραση:το μεθάνιο καίγεται στον αέρα και συνδυάζεται με οξυγόνο για να παράγει διοξείδιο του άνθρακα και υδρατμούς
1. Γράψτε την Εξίσωση Λέξεων
Γράψτε την αντίδραση ως εξίσωση λέξης:μεθάνιο + οξυγόνο → διοξείδιο του άνθρακα + νερό
2. Ξαναγράψτε την εξίσωση λέξης ως εξίσωση τύπου
Ξαναγράψτε ως εξίσωση τύπου:CH4 (ζ) + O2 (ζ) → CO2 (ζ) + H2 O (g)
3. Ισορροπήστε την εξίσωση του τύπου χρησιμοποιώντας το νόμο της διατήρησης της μάζας.
- Μετρήστε τα άτομα των στοιχείων που εμφανίζονται μία φορά στην εξίσωση. Σε αυτό το παράδειγμα, τα άτομα άνθρακα και υδρογόνου εμφανίζονται μία φορά και το οξυγόνο εμφανίζεται δύο φορές στη δεξιά πλευρά.
- Ισορροπήστε τα άτομα υδρογόνου και οξυγόνου διαρκούν. Εφόσον το οξυγόνο εμφανίζεται δύο φορές, θα εξισορροπήσετε το οξυγόνο τελευταίο. Στο παράδειγμα, θα ξεκινούσατε εξισορροπώντας τον άνθρακα και μετά το υδρογόνο και το οξυγόνο.
- Υπάρχει ένα άτομο άνθρακα στην αριστερή πλευρά της εξίσωσης (CH4 ), και ένα στη δεξιά πλευρά (CO2 ). Επομένως, ο άνθρακας είναι ήδη ισορροπημένος. Και οι δύο ενώσεις που περιέχουν άνθρακα (CH4 και CO2 ) θα πρέπει να έχουν συντελεστή 1, γιατί πρέπει να υπάρχουν εξίσου για να έχουν ίσο αριθμό ατόμων άνθρακα.
- Υπάρχουν 4 άτομα υδρογόνου στην αριστερή πλευρά της εξίσωσης (CH4 ), και 2 στη δεξιά πλευρά (H2 Ο). Θα χρειαστείτε άλλα 2 άτομα υδρογόνου στη δεξιά πλευρά για να εξισορροπήσετε τα άτομα υδρογόνου. Πολλαπλασιάζοντας τον συντελεστή H2 Ο επί 2 δίνει 2H2 Ο, που έχει 4 άτομα υδρογόνου.
- Είναι σημαντικό να μην προσπαθήσετε να αλλάξετε το H2 O έως H4 O σε μια προσπάθεια εξισορρόπησης των ατόμων υδρογόνου. Με αυτόν τον τρόπο αλλάζει η χημική ταυτότητα και το H4 Το O δεν είναι νερό. Πολλαπλασιάζοντας ολόκληρη την ένωση (H2 Ο) αλλάζει τον αριθμό των μορίων του νερού στην αντίδραση, χωρίς να αλλοιώνει τη χημική του ταυτότητα.
- Η εξίσωση του τύπου είναι τώρα:1CH4 (ζ) + 1O2 (ζ) → 1CO2 (ζ) + 2Η2 O (g)
- Τώρα υπάρχουν 2 άτομα οξυγόνου στην αριστερή πλευρά (O2 ) και 4 στη δεξιά πλευρά (2H2 O και CO2 ). Πολλαπλασιάζοντας τον συντελεστή O2 από το 2 δίνει 2O2 , που έχει 4 άτομα οξυγόνου.
- Αφού όλα τα άτομα εξισορροπηθούν, έχετε μια χημική εξίσωση:CH4 (ζ) + 2O2 (ζ) → CO2 (ζ) + 2Η2 O (g)
4. Ελέγξτε την ισορροπημένη εξίσωση μετρώντας όλα τα άτομα.
| Αριστερή πλευρά | Δεξιά πλευρά |
| άτομα άνθρακα – 1 (CH4 ) | άτομα άνθρακα – 1 (CO2 ) |
| άτομα υδρογόνου – 4 (CH4 ) | άτομα υδρογόνου – 4 (2H2 O) |
| άτομα οξυγόνου – 4 (2O2 ) | άτομα οξυγόνου – 4 (2 από CO2 , 2 από 2H2 O) |
Περαιτέρω ανάγνωση
- Πώς να γράψετε καθαρές ιοντικές εξισώσεις
- Αντιδράσεις οξειδοαναγωγής ισορροπίας
- Τύποι χημικών αντιδράσεων
- Περιοριστικό αντιδραστήριο




