Αντίδραση Εξάλειψης
Η οργανική αντίδραση κατά την οποία δύο ή περισσότερα άτομα αφαιρούνται από ένα μόριο ονομάζεται αντίδραση αποβολής. Η απομάκρυνση γίνεται μέσω της δράσης μετάλλων, οξέων ή βάσεων ή ακόμα και με αύξηση της θερμότητας σε υψηλή θερμοκρασία. Σε μια αντίδραση εξάλειψης, οι απλοί δεσμοί μεταξύ ατόμων άνθρακα μετασχηματίζονται σε διπλούς ή τριπλούς δεσμούς. Με άλλα λόγια, οι κορεσμένες ενώσεις μετατρέπονται σε ακόρεστες ενώσεις.
Η αντίδραση αποβολής κατηγοριοποιείται με βάση τον τύπο των ατόμων που αφήνουν ένα μόριο. Για παράδειγμα, η απομάκρυνση δύο ατόμων υδρογόνου ονομάζεται αφυδρογόνωση. Η απομάκρυνση ενός υδρογόνου και δύο ατόμων οξυγόνου (ένα μόριο νερού) ονομάζεται αφυδάτωση ή β-αποβολή. Η απομάκρυνση ενός ατόμου υδρογόνου και ενός ατόμου αλογόνου ονομάζεται αφυδροαλογόνωση. Η απομάκρυνση δύο αλογόνων ονομάζεται αποαλογόνωση. Ανάλογα με την κινητική της αντίδρασης, η αντίδραση απομάκρυνσης ταξινομείται επίσης ως αντιδράσεις Ε1 και Ε2.
Μηχανισμός μιας αντίδρασης εξάλειψης
Μια αντίδραση αποβολής περιλαμβάνει τους ακόλουθους βασικούς μηχανισμούς:
Εξάλειψη πρωτονίου
Σχηματισμός του δεσμού pi μεταξύ δύο ατόμων άνθρακα (C=C)
Χάσιμο του δεσμού που συνδέεται με μια ομάδα που αποχωρεί
Αντίδραση E1
Μια αντίδραση μονομοριακής απομάκρυνσης αναφέρεται ως αντίδραση Ε1.
Ο ρυθμός αυτής της αντίδρασης είναι k [R-LG], πράγμα που σημαίνει ότι το στάδιο στο οποίο ένα μοριακό είδος αποσυντίθεται, καθορίζει τον ρυθμό της αντίδρασης.
Το πρώτο βήμα της αντίδρασης Ε1 περιλαμβάνει την απώλεια μιας αποχωρούσας ομάδας (LG) που οδηγεί στον σχηματισμό θετικού φορτίου σε ένα άτομο άνθρακα (ενδιάμεσο καρβοκατιόν) . Αυτό μπορεί να απεικονιστεί ως εξής:
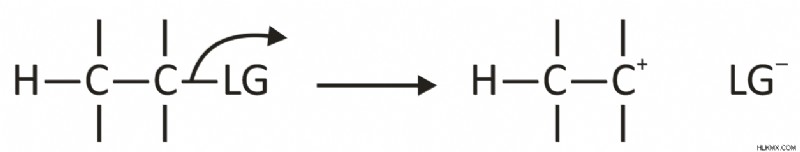
Το δεύτερο βήμα περιλαμβάνει την απώλεια ενός ιόντος Η+ σε μια βάση (Β) που οδηγεί στο σχηματισμό ενός δεσμού pi. Αυτό μπορεί να απεικονιστεί ως εξής:
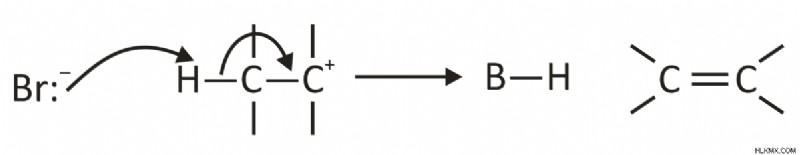
Ο ρυθμός της αντίδρασης καθορίζεται από το βήμα όπου η αποχωρούσα ομάδα χάνεται από την οργανική ένωση για να σχηματιστεί ένα ενδιάμεσο.
Η αντίδραση μπορεί να είναι γρήγορη ή αργή, με βάση τη φύση της ομάδας που αποχωρεί. Αυτό συμβαίνει επειδή το βήμα καθορισμού του ποσοστού βασίζεται στην απώλεια της ομάδας αποχώρησης.
Η φύση της Βάσης (Β) δεν είναι σημαντική, καθώς το δεύτερο βήμα δεν επηρεάζει τον ρυθμό της αντίδρασης.
Αντίδραση E2
Μια αντίδραση διμοριακής απομάκρυνσης αναφέρεται ως αντίδραση Ε2.
Ο ρυθμός αυτής της αντίδρασης μπορεί να γραφτεί ως k[B][R-LG], πράγμα που σημαίνει ότι το βήμα στο οποίο υπάρχει μια αλληλεπίδραση μεταξύ της Βάσης ( Β) και το οργανικό υπόστρωμα (R-LG) είναι το στάδιο προσδιορισμού της ταχύτητας της αντίδρασης.
Σε αυτήν την αντίδραση, υπάρχει ταυτόχρονη απομάκρυνση της αποχωρούσας ομάδας, αφαίρεση του πρωτονίου (H+) από τη βάση και σχηματισμός του δεσμού pi.
Η αντίδραση Ε2 μπορεί να απεικονιστεί ως εξής:
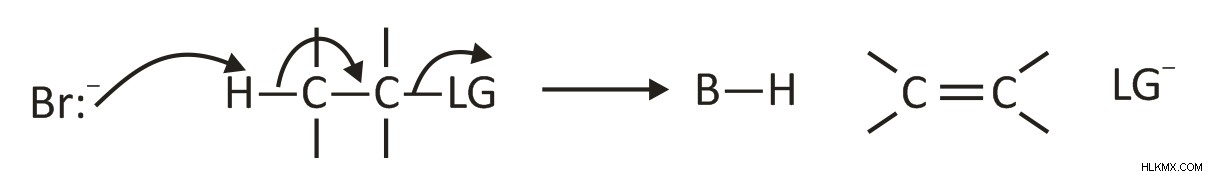
Τα sp3 υβριδοποιημένα άτομα άνθρακα αλλάζουν σε sp2 υβριδισμένα.
Η φύση της αποχωρούσας ομάδας επηρεάζει τον ρυθμό της αντίδρασης καθώς φεύγει κατά τη διάρκεια του βήματος προσδιορισμού του ρυθμού της αντίδρασης.
Μια αντίδραση Ε2 μπορεί να αλλάξει σε αντίδραση Ε1 εάν η αποχωρούσα ομάδα είναι πολύ καλή.
Η φύση της βάσης επηρεάζει επίσης τον ρυθμό της αντίδρασης καθώς φεύγει επίσης κατά τη διάρκεια του βήματος προσδιορισμού του ρυθμού της αντίδρασης.
Μια πιο αντιδραστική βάση θα ευνοήσει την ταχύτητα της αντίδρασης Ε2.
Αντίδραση E1CB
Μια αντίδραση μονομοριακής (E1) συζυγούς βάσης (CB) αναφέρεται ως αντίδραση E1CB.
Αυτή είναι μια αντίδραση δύο βημάτων.
Στο πρώτο βήμα, το υδρογόνο απομακρύνεται από μια βάση (Β) που οδηγεί στο σχηματισμό ενός ανιόντος αλκοξειδίου. Με άλλα λόγια, το πρώτο βήμα περιλαμβάνει την αποπρωτονίωση για να σχηματιστεί ένα ανιόν. Το πρώτο βήμα μπορεί να απεικονιστεί ως εξής:
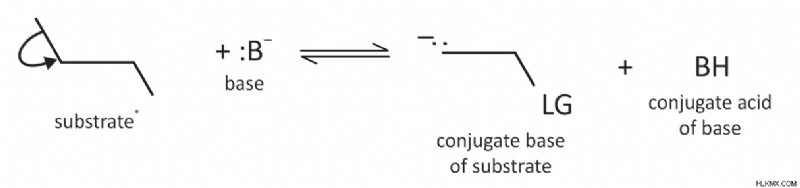
Στο δεύτερο βήμα, σχηματίζεται ένας δεσμός pi όταν αφαιρείται η αποχωρούσα ομάδα (LG) και μετατοπίζεται από ένα ζεύγος ηλεκτρονίων από τη συζυγή βάση (εξ ου και η όρος CB) ως εξής:
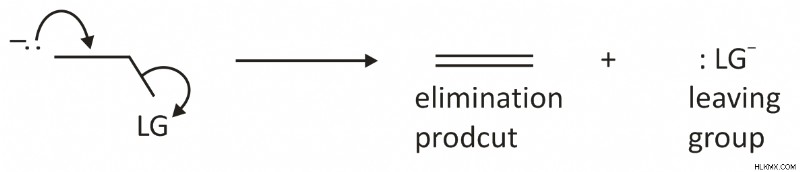
Μια κακή αποχωρούσα ομάδα επιβραδύνει την αντίδραση, επομένως το δεύτερο βήμα της αντίδρασης καθορίζει τον ρυθμό της.
Συμπέρασμα
Η οργανική αντίδραση κατά την οποία δύο ή περισσότερα άτομα αφαιρούνται από ένα μόριο ονομάζεται αντίδραση απομάκρυνσης. Ο μηχανισμός μιας αντίδρασης απομάκρυνσης περιλαμβάνει την απομάκρυνση ενός πρωτονίου, το σχηματισμό ενός δεσμού pi και την απομάκρυνση μιας αποχωρούσας ομάδας.
Υπάρχουν τρεις τύποι αντιδράσεων αποβολής:E1, E2 και E1CB. Στην αντίδραση Ε1, μια αποχωρούσα ομάδα αφαιρείται, ακολουθούμενη από την απομάκρυνση ενός ιόντος υδρογόνου από μια βάση, η οποία οδηγεί στο σχηματισμό ενός δεσμού pi. Στην αντίδραση Ε2, υπάρχει ταυτόχρονη απομάκρυνση της αποχωρούσας ομάδας, αφαίρεση του ιόντος Η+ από τη βάση και σχηματισμός του δεσμού pi. Σε μια αντίδραση E1CB, ένα ιόν υδρογόνου απομακρύνεται από μια βάση, ακολουθούμενο από το σχηματισμό ενός δεσμού pi, όταν η αποχωρούσα ομάδα (LG) αφαιρείται και εκτοπίζεται από ένα ζεύγος ηλεκτρονίων από τη συζυγή βάση.