Ιόν υδρονίου ή οξώνιο
Στη χημεία, υδρόνιο ή το ιόν υδρονίου αναφέρεται στο χημικό είδος H3 Ο. Το Υδρόνιο είναι το απλούστερο ιόν οξωνίου , όπου ένα ιόν οξωνίου είναι οποιοδήποτε κατιόν οξυγόνου που έχει τρεις χημικούς δεσμούς. Η Διεθνής Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC) συνιστά τη χρήση του όρου «οξόνιο» ή «υδροξόνιο» αντί της λέξης «υδρόνιο». Ωστόσο, το υδρόνιο παραμένει το κοινό όνομα για το ιόν.
Χωρίς ελεύθερο υδρογόνο στο νερό
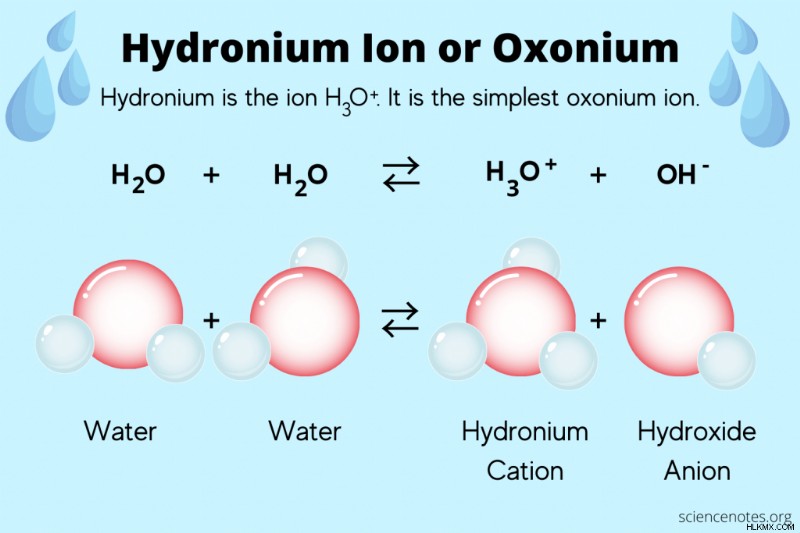
Τα ιόντα υδρογόνου (Η) εμφανίζονται σε χημικές εξισώσεις σε υδατικό διάλυμα και υπολογισμούς pH, αλλά τα ελεύθερα ιόντα υδρογόνου στην πραγματικότητα δεν επιπλέουν στο νερό. Αντίθετα, η απίστευτα υψηλή πυκνότητα θετικού φορτίου του πρωτονίου (ιόν υδρογόνου) το κάνει να συνδέεται αμέσως με ένα ή περισσότερα μόρια νερού, σχηματίζοντας υδρόνιο.
Έτσι, μια εξίσωση για την αυτόματη διάσταση του νερού είναι η εξής:
H2 O → H(aq) + OH(aq)
Όμως, μια πιο ακριβής χημική εξίσωση δείχνει το υδρόνιο:
2 H2 O(l ) ↔ H3 O(aq ) + OH(aq )
Δομή υδρονίου
Ακόμη και αυτή η εξίσωση είναι μια υπεραπλούστευση. Όταν το νερό διασπάται αυτόματα, το ιόν υδρογόνου δεν συνδέεται πάντα με ένα μόνο μόριο νερού και δεν σχηματίζει υδρόνιο. Συχνά, το πρωτόνιο συνδέεται με πολλαπλά μόρια, πηδώντας από το ένα στο άλλο. Ομοίως, το ιόν υδροξειδίου αλληλεπιδρά με πολλαπλά μόρια νερού.
Στο κρύο νερό, ένα ιόν υδρονίου αλληλεπιδρά με κατά μέσο όρο έξι μόρια νερού. Ωστόσο, υπάρχουν άλλες δομές. Για παράδειγμα, H3 O(H2 O)20 είναι μια πολύ σταθερή δομή ή «μαγικός αριθμός». Στο άλλο άκρο του φάσματος, το κατιόν Zundel (H5 O2 ) περιλαμβάνει δύο μόρια νερού που μοιράζονται εξίσου το υδρογόνο μέσω ενός συμμετρικού δεσμού υδρογόνου. Το Ιγόνο κατιόν (H9 O4 ) έχει το ιόν υδρονίου που δρα ως κέντρο για τρία μόρια νερού, που συνδέονται επίσης με δεσμούς υδρογόνου.
Το ίδιο το ιόν υδρονίου παίρνει το σχήμα μιας τριγωνικής πυραμίδας, με το οξυγόνο στην κορυφή της πυραμίδας. Το κέντρο μάζας του ιόντος είναι κοντά στο ιόν οξυγόνου. Η γωνία σύνδεσης H-O-H είναι περίπου 113°.
Σημασία του Hydronium
Η έννοια του ιόντος υδρονίου είναι σημαντική στους υπολογισμούς του pH, στη χημεία οξέος-βάσης και στη διαστρική χημεία.
Ο τύπος του pH έχει λοιπόν δύο μορφές:
pH =-log[H]
pH =-log[H3 O]
Το ιόν υδρογόνου ή το ιόν υδρονίου αποτελεί τη βάση για τον ορισμό του οξέος Arrhenius. Άρα, η διάσταση του υδροχλωρικού οξέος γίνεται:
HCl(aq) + H2 O → H3 O(aq) + Cl(aq)
Για τους περισσότερους υπολογισμούς, δεν έχει σημασία αν χρησιμοποιείτε H ή H3 O, αλλά αξίζει να γνωρίζετε ότι κάποια ενδιαφέρουσα χημεία περιλαμβάνει το υδρόνιο που δρα ως κατιόν στις ενώσεις. Για παράδειγμα, ορισμένα ισχυρά οξέα σχηματίζουν κρυστάλλους αλάτων υδρονίου. Η ανάμειξη υγρού ανύδρου υπερχλωρικού οξέος και νερού σε αναλογία 1:1 σχηματίζει στερεό υπερχλωρικό υδρόνιο (H3 O·ClO4 ).
Στη διαστρική χημεία, το υδρόνιο εμφανίζεται σε διάχυτα και πυκνά μοριακά νέφη, στο διαστρικό μέσο και στις ουρές πλάσματος του κομήτη. Συνήθως, αυτό ξεκινά με τον ιονισμό του H2 (μοριακό υδρογόνο) σε H2 από την κοσμική ακτινοβολία. Ωστόσο, είναι δυνατές αρκετές αντιδράσεις ανασυνδυασμού, σχηματίζοντας νερό, το ιόν υδρονίου και το ιόν υδροξειδίου.
Αναφορές
- Burgot, Jean-Louis (1998). «Νέα άποψη για την έννοια και τις τιμές του Ka○(H3 O, H2 O) και Kb○(H2 Ο, ΟΗ) ζεύγη στο νερό». Ο Αναλυτής . 123 (2):409–410. doi:10.1039/a705491b
- Herbst, E.; Klemperer, W. (1973). «Σχηματισμός και εξάντληση μορίων σε πυκνά διαστρικά νέφη». The Astrophysical Journal . 185:505. doi:10.1086/152436
- IUPAC (1997). «Ιόντα οξονίου». Compendium of Chemical Terminology (the “Gold Book”) (2η έκδ.). Επιστημονικές Εκδόσεις Blackwell, Οξφόρδη. ISBN 0-9678550-9-8. doi:10.1351/goldbook
- Meister, Erich; Willeke, Martin; Angst, Werner; Togni, Antonio; Walde, Peter (2014). «Συγχυτικές ποσοτικές περιγραφές των ισορροπιών οξέος-βάσης Brønsted-Lowry σε σχολικά βιβλία Χημείας – Μια κριτική ανασκόπηση και διευκρινίσεις για εκπαιδευτές χημικών». Ελβ. Chim. Acta . 97 (1):1–31. doi:10.1002/hlca.201300321
- Olah, George A. (1998). Ιόντα ονίου . John Wiley &Sons. ISBN 9780471148777.




