Διαφορά μεταξύ μετάλλων και μη μετάλλων και μεταλλοειδών
Κύρια διαφορά – Μέταλλα vs Αμέταλλα vs Μεταλλοειδή
Ο περιοδικός πίνακας στοιχείων υποδεικνύει όλα τα στοιχεία που έχουν ανακαλυφθεί στη γη. Αυτά τα μέταλλα μπορούν να ταξινομηθούν σε διαφορετικές κατηγορίες ανάλογα με τις ομοιότητες στις ιδιότητές τους. Ωστόσο, ο κύριος τρόπος κατηγοριοποίησης αυτών των στοιχείων είναι ανάλογα με το βαθμό των μεταλλικών ιδιοτήτων που εμφανίζουν. Τα στοιχεία κατηγοριοποιούνται σε μέταλλα, αμέταλλα και μεταλλοειδή σύμφωνα με αυτή την ταξινόμηση. Ένα μέταλλο είναι ένα στοιχείο που είναι συνήθως σκληρό, γυαλιστερό, εύτηκτο, εύπλαστο και όλκιμο, με καλή ηλεκτρική και θερμική αγωγιμότητα. Μη μέταλλο είναι ένα στοιχείο που δεν έχει τις ιδιότητες ενός μετάλλου. Ένα μεταλλοειδές είναι ένα στοιχείο που έχει ενδιάμεσες ιδιότητες τόσο των μετάλλων όσο και των μη μετάλλων. Αυτή είναι η κύρια διαφορά μεταξύ των μετάλλων, των μη μετάλλων και των μεταλλοειδών.
Βασικές περιοχές που καλύπτονται
1. Τι είναι μέταλι
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι ένα μη μέταλλο
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Τι είναι ένα Metalloid
– Ορισμός, Ιδιότητες, Παραδείγματα
4. Ποια είναι η διαφορά μεταξύ Metal Nonmetal και Metalloid
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ελατότητα, Ελατότητα, Μέταλλο, Μεταλλοειδές, Μη μέταλλο

Τι είναι μέταλλο
Τα μέταλλα είναι στοιχεία με τον υψηλότερο βαθμό μεταλλικής συμπεριφοράς. Τα μέταλλα βρίσκονται στην αριστερή πλευρά του περιοδικού πίνακα. Έχουν μια χαρακτηριστική μεταλλική εμφάνιση γνωστή ως λάμψη ή λάμψη. Η ολκιμότητα και η ελατότητα είναι ένα κύριο χαρακτηριστικό των μετάλλων. Η ελατότητα αναφέρεται στην ικανότητα ενός μετάλλου να παραμορφώνεται υπό πίεση και η ολκιμότητα αναφέρεται στην ικανότητά του να έλκεται σε δομές που μοιάζουν με σύρμα.
Τα μέταλλα είναι συνήθως στερεά σε θερμοκρασία δωματίου. Αλλά ο υδράργυρος αποτελεί εξαίρεση. Αν και ο υδράργυρος είναι μεταλλικό στοιχείο, είναι υγρό σε θερμοκρασία δωματίου γιατί όλα τα άλλα μέταλλα έχουν συνήθως υψηλότερα σημεία τήξης. Σε αντίθεση με άλλα άτομα μετάλλων, τα άτομα υδραργύρου είναι αδύναμα στο να μοιράζονται ηλεκτρόνια μεταξύ τους, επομένως έχουν ασθενείς αλληλεπιδράσεις. Επομένως, τα άτομα υδραργύρου μπορούν εύκολα να διαφύγουν, με αποτέλεσμα χαμηλότερο σημείο τήξης.

Εικόνα 1:Ο Πύργος του Άιφελ – Κατασκευασμένος από μέταλλα.
Τα μέταλλα είναι εξαιρετικοί αγωγοί της θερμότητας και του ηλεκτρικού ρεύματος επειδή χάνουν εύκολα ηλεκτρόνια που έχουν την ικανότητα να συμμετέχουν στην αγωγή του ηλεκτρισμού. Με άλλα λόγια, τα μέταλλα έχουν ελεύθερα ηλεκτρόνια. Τα μέταλλα υφίστανται συνήθως διάβρωση υπό συνθήκες υγρασίας και παρουσία αλμυρού νερού.
Στον περιοδικό πίνακα, τα μεταλλικά στοιχεία βρίσκονται σε όλα τα μπλοκ s, p, d και f. Τα μέταλλα έχουν μικρότερο αριθμό ηλεκτρονίων στα εξωτερικά s και p τροχιακά τους (εκτός από λίγα μέταλλα). Κανονικά τα μέταλλα μπορούν να σχηματίσουν κατιόντα και οι αριθμοί οξείδωσής τους είναι σχεδόν πάντα θετικές τιμές. Τα μέταλλα παρουσιάζουν επίσης πολύ χαμηλές ηλεκτραρνητικές τιμές και σχηματίζουν ιοντικές ενώσεις.
Τι είναι το μη μέταλλο
Τα μη μέταλλα είναι στοιχεία που εμφανίζουν λιγότερες ή καθόλου μεταλλικές ιδιότητες. Τα αμέταλλα έχουν πολύ ξεχωριστές ιδιότητες από εκείνες των μετάλλων και των μεταλλοειδών. Συνήθως τα αμέταλλα έχουν θαμπή εμφάνιση, καθώς δεν έχουν μεταλλική εμφάνιση.
Σε αντίθεση με τα μέταλλα, τα αμέταλλα δεν είναι εύπλαστα ή όλκιμα. Είναι εύθραυστα. Τα αμέταλλα είναι κακοί αγωγοί του ηλεκτρισμού και της θερμότητας. Σε σύγκριση με τα μέταλλα, τα αμέταλλα είναι λιγότερο πυκνά. Τα περισσότερα από τα αμέταλλα είναι αέρια. Υπάρχουν όμως και υγρά και στερεά.

Εικόνα 2:Διαμάντι κατασκευασμένο από άνθρακα. μη μέταλι
Τα μη μέταλλα περιλαμβάνονται στη δεξιά πλευρά του περιοδικού πίνακα. Αυτά τα αμέταλλα περιλαμβάνονται στα μπλοκ s και p. Αυτά τα στοιχεία έχουν μεγάλο αριθμό ηλεκτρονίων στα εξώτατα s και p τροχιακά. Δεν έχουν καθόλου ή έχουν λίγα ελεύθερα ηλεκτρόνια.
Τα μη μέταλλα έχουν πολύ χαμηλά σημεία τήξης. Τείνουν να σχηματίζουν ανιόντα κερδίζοντας ηλεκτρόνια. Σχηματίζουν ομοιοπολικές ενώσεις. Ο αριθμός οξείδωσης ενός αμέταλλου μπορεί να είναι είτε θετικός είτε αρνητικός. Η ηλεκτροαρνητικότητα είναι πολύ υψηλή στα αμέταλλα.
Τι είναι ένα Metalloid
Τα μεταλλοειδή είναι στοιχεία με χαμηλό βαθμό μεταλλικής συμπεριφοράς. Τα μεταλλοειδή παρουσιάζουν κάποιες μεταλλικές ιδιότητες και κάποιες μη μεταλλικές ιδιότητες. Η εμφάνιση των μεταλλοειδών μπορεί να είναι είτε θαμπή είτε γυαλιστερή. Αν και δεν είναι εξαιρετικοί θερμικοί και ηλεκτρικοί αγωγοί, τα μεταλλοειδή είναι ικανά να μεταφέρουν θερμότητα και ηλεκτρισμό.
Η κύρια εφαρμογή των μεταλλοειδών είναι στην παραγωγή ημιαγωγών. Όλα τα μεταλλοειδή είναι στερεά σε θερμοκρασία δωματίου. Η πυκνότητα των μεταλλοειδών είναι μεταξύ μετάλλων και αμετάλλων. Είναι εύθραυστα. Τα μεταλλοειδή τοποθετούνται σε μπλοκ p στον περιοδικό πίνακα. Αυτά τα στοιχεία είναι τοποθετημένα ανάμεσα σε μέταλλα και αμέταλλα στον περιοδικό πίνακα. Ο αριθμός των ηλεκτρονίων στα τροχιακά s και p είναι ένας μεσαίος αριθμός.

Εικόνα 3:Ένας ημιαγωγός κατασκευασμένος από μεταλλοειδή
Τα μεταλλοειδή σχηματίζουν ομοιοπολικούς δεσμούς. Επομένως, τα μεταλλοειδή βρίσκονται σε ομοιοπολικές ενώσεις. Δεδομένου ότι τα μεταλλοειδή είναι στερεά σε θερμοκρασία δωματίου, έχουν υψηλά σημεία τήξης. Σε υδατικά διαλύματα, τα μεταλλοειδή σχηματίζουν ανιόντα και εμφανίζουν θετικούς ή αρνητικούς αριθμούς οξείδωσης.
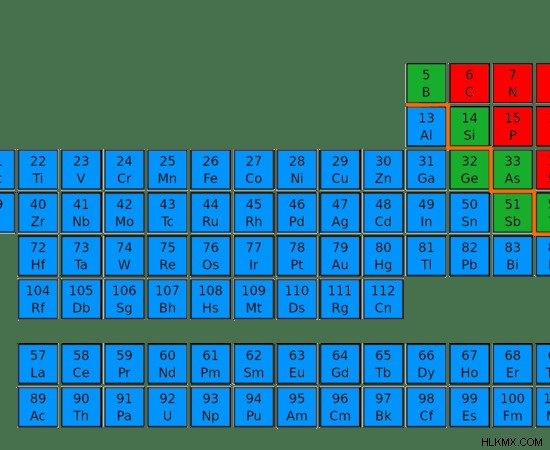
Εικόνα 4:Θέση μετάλλων (μπλε), μη μετάλλων (κόκκινο) και μεταλλοειδών (πράσινο) στον περιοδικό πίνακα
Διαφορά μεταξύ μη μετάλλων και μεταλλοειδών
Ορισμός
Μέταλλα: Τα μέταλλα είναι στοιχεία με τον υψηλότερο βαθμό μεταλλικής συμπεριφοράς.
Μη μέταλλα: Τα μη μέταλλα είναι στοιχεία που παρουσιάζουν λιγότερες ή καθόλου μεταλλικές ιδιότητες.
Μεταλλοειδή: Τα μεταλλοειδή είναι στοιχεία με χαμηλό βαθμό μεταλλικής συμπεριφοράς.
Θέση στον περιοδικό πίνακα
Μέταλλα: Τα μέταλλα βρίσκονται στην αριστερή πλευρά του περιοδικού πίνακα.
Μη μέταλλα: Τα αμέταλλα βρίσκονται στη δεξιά πλευρά του περιοδικού πίνακα.
Μεταλλοειδή: Τα μεταλλοειδή βρίσκονται στη μέση του περιοδικού πίνακα.
Αποκλεισμός στον περιοδικό πίνακα
Μέταλλα: Τα μέταλλα βρίσκονται σε μπλοκ s, p, d και f.
Μη μέταλλα: Τα μη μέταλλα βρίσκονται στα μπλοκ s και p.
Μεταλλοειδή: Τα μεταλλοειδή βρίσκονται στο μπλοκ p.
Εμφάνιση
Μέταλλα: Τα μέταλλα έχουν λαμπερή εμφάνιση.
Μη μέταλλα: Τα μη μέταλλα έχουν θαμπή εμφάνιση.
Μεταλλοειδή: Τα μεταλλοειδή έχουν θαμπή ή λαμπερή εμφάνιση.
Ελατότητα και ολκιμότητα
Μέταλλα: Τα μέταλλα παρουσιάζουν ελατότητα και ολκιμότητα.
Μη μέταλλα: Τα αμέταλλα δεν παρουσιάζουν ελαττότητα και ολκιμότητα.
Μεταλλοειδή: Τα μεταλλοειδή δεν παρουσιάζουν ελατότητα και ολκιμότητα.
Θερμική και ηλεκτρική αγωγιμότητα
Μέταλλα: Η θερμική και ηλεκτρική αγωγιμότητα των μετάλλων είναι πολύ υψηλή.
Μη μέταλλα: Η θερμική και ηλεκτρική αγωγιμότητα των μη μετάλλων είναι πολύ χαμηλή.
Μεταλλοειδή: Η θερμική και ηλεκτρική αγωγιμότητα των μεταλλοειδών είναι καλή αλλά μικρότερη από τα μέταλλα.
Ηλεκτραρνητικότητα
Μέταλλα: Τα μέταλλα έχουν πολύ χαμηλή ηλεκτραρνητικότητα.
Μη μέταλλα: Τα αμέταλλα παρουσιάζουν πολύ υψηλή ηλεκτραρνητικότητα.
Μεταλλοειδή: Τα μεταλλοειδή έχουν μια ενδιάμεση τιμή ηλεκτραρνητικότητας.
Συμπέρασμα
Τα μέταλλα, τα αμέταλλα και τα μεταλλοειδή είναι στοιχεία που βρίσκονται στη γη. Τα περισσότερα από αυτά τα στοιχεία χρησιμοποιούνται σε διάφορες εφαρμογές. Η κύρια διαφορά μεταξύ των μη μετάλλων και των μεταλλοειδών είναι ότι τα μέταλλα παρουσιάζουν τον υψηλότερο βαθμό μεταλλικής συμπεριφοράς και τα αμέταλλα δεν παρουσιάζουν μεταλλική συμπεριφορά, ενώ τα μεταλλοειδή παρουσιάζουν κάποιο βαθμό μεταλλικής συμπεριφοράς.
Αναφορές:
1. Helmenstine, Ph.D. Άννα Μαρί. «Μέταλλα Αμέταλλα και Μεταλλοειδή – Περιοδικός Πίνακας». ThoughtCo. Ν.π., ν.δ. Ιστός. Διαθέσιμο εδώ. 26 Ιουνίου 2017.
2. Libretexts. «Μέταλλα, Αμέταλλα και Μεταλλοειδή». LibreTexts Χημείας. Libretexts, 25 Οκτ. 2016. Web. Διαθέσιμο εδώ. 26 Ιουνίου 2017.
3. Boudreaux, Kevin A. «Metals, Nonmetals, and Metalloids». Τα μέρη του περιοδικού πίνακα. Ν.π., ν.δ. Ιστός. Διαθέσιμο εδώ. 26 Ιουνίου 2017.
Εικόνα Ευγενική προσφορά:
1.”2267674″ (Δημόσιος Τομέας) μέσω Pixabay
2. "Apollo synthetic diamond" Από τον Steve Jurvetson – (CC BY 2.0) μέσω Commons Wikimedia
3. "National Semiconductor 8250A" By Nixdorf – Δική του δουλειά (CC BY-SA 3.0) μέσω Commons Wikimedia
4. "Metalli, semimetalli, nonmetalli" Από τον Riccardo Rovinetti – Δικό έργο (CC BY-SA 3.0) μέσω Commons Wikimedia




