Διαφορά μεταξύ πυρηνόφιλης και ηλεκτρόφιλης αντίδρασης υποκατάστασης
Κύρια διαφορά – Πυρηνόφιλη και Ηλεκτρόφιλη Αντίδραση Υποκατάστασης
Τόσο οι πυρηνόφιλες όσο και οι ηλεκτρόφιλες αντιδράσεις υποκατάστασης βρίσκονται στην οργανική και στην ανόργανη χημεία. Αυτές οι αντιδράσεις υποκατάστασης είναι πολύ σημαντικές για τη σύνθεση ορισμένων ενώσεων. Μια αντίδραση υποκατάστασης είναι μια αντίδραση που περιλαμβάνει την αντικατάσταση ενός ατόμου ή μιας ομάδας ατόμων από ένα άλλο άτομο ή μια ομάδα ατόμων. Η κύρια διαφορά μεταξύ πυρηνόφιλης και ηλεκτρόφιλης αντίδρασης υποκατάστασης είναι ότι η αντίδραση πυρηνόφιλης υποκατάστασης περιλαμβάνει τη μετατόπιση μιας αποχωρούσας ομάδας από ένα πυρηνόφιλο ενώ η αντίδραση ηλεκτρόφιλης υποκατάστασης περιλαμβάνει τη μετατόπιση μιας λειτουργικής ομάδας από ένα ηλεκτρόφιλο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η αντίδραση πυρηνόφιλης υποκατάστασης
– Ορισμός, Διαδικασία αντίδρασης, Παραδείγματα
2. Τι είναι η αντίδραση ηλεκτρόφιλης υποκατάστασης
– Ορισμός, Διαδικασία αντίδρασης, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ πυρηνόφιλης και ηλεκτρόφιλης αντίδρασης υποκατάστασης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αλειφατικές και Αρωματικές Ενώσεις, Ηλεκτρόφιλο, Ηλεκτρόφιλη Υποκατάσταση, Ομάδα Αποχώρησης, Πυρηνόφιλο, Πυρηνόφιλη Υποκατάσταση, SE 1 Αντίδραση, SE 2 Αντίδραση, SN 1 Αντίδραση, SN 2 Αντίδραση, Αντίδραση υποκατάστασης 
Τι είναι η πυρηνόφιλη αντίδραση υποκατάστασης
Μια αντίδραση πυρηνόφιλης υποκατάστασης είναι μια χημική αντίδραση που περιλαμβάνει τη μετατόπιση μιας αποχωρούσας ομάδας από ένα πυρηνόφιλο. Αυτή η αποχωρούσα ομάδα έχει αυτό το όνομα επειδή φεύγει όταν ένα πυρηνόφιλο αντιδρά με το μόριο στο οποίο είναι προσκολλημένη η αποχωρούσα ομάδα (ολόκληρο το μόριο ονομάζεται υπόστρωμα). Το τμήμα στο οποίο πρόκειται να συνδεθεί το πυρηνόφιλο ονομάζεται ηλεκτρόφιλο. Αυτό το ηλεκτρόφιλο στερείται ηλεκτρονίων για να γίνει σταθερό. Επομένως, δέχεται ηλεκτρόνια από ένα πυρηνόφιλο. Αυτό έχει ως αποτέλεσμα το σχηματισμό ενός ομοιοπολικού δεσμού μεταξύ πυρηνόφιλου και ηλεκτροφίλου.
Τις περισσότερες φορές, το πυρηνόφιλο είναι αρνητικά φορτισμένο. Αλλά μπορεί επίσης να είναι ένα ουδέτερα φορτισμένο μόριο που έχει ένα ελεύθερο ζεύγος ηλεκτρονίων που είναι έτοιμο για δωρεά. Αυτές οι αντιδράσεις πυρηνόφιλης υποκατάστασης λαμβάνουν χώρα σε αλειφατικές και αρωματικές οργανικές ενώσεις.
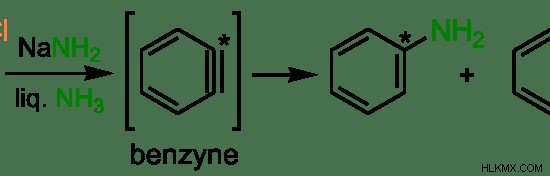
Εικόνα 1:Παράδειγμα πυρηνόφιλης υποκατάστασης σε αρωματικές ενώσεις
Στο παραπάνω παράδειγμα, ο δακτύλιος βενζολίου συνδέεται με ένα άτομο χλωρίου (Cl). Είναι η αποχωρούσα ομάδα παρουσία NaNH2 . Το πυρηνόφιλο είναι –NH2 ομάδα. Το άτομο άνθρακα (με ένα σημάδι αστεριού στην παραπάνω εικόνα) δέχεται επίθεση από το πυρηνόφιλο και το άτομο Cl εκτοπίζεται από –NH2 ομάδα. Αυτό ονομάζεται πυρηνόφιλη υποκατάσταση.
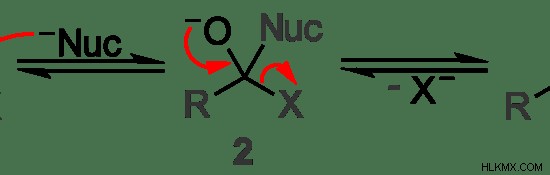
Εικόνα 2:Παράδειγμα πυρηνόφιλης υποκατάστασης σε αρωματικές ενώσεις
Στο παραπάνω παράδειγμα, το πυρηνόφιλο υποδεικνύεται με το σύμβολο "Nuc". Το άτομο άνθρακα στο κέντρο δέχεται επίθεση από το πυρηνόφιλο και η αποχωρούσα ομάδα "Χ" εκτοπίζεται από το πυρηνόφιλο. Μπορεί να φανεί καθαρά όταν εξετάζουμε τη διαφορά μεταξύ του πρώτου και του τελευταίου μορίου στην παραπάνω εικόνα.
Υπάρχουν δύο κύριοι τύποι πυρηνόφιλων αντιδράσεων υποκατάστασης που κατηγοριοποιούνται ανάλογα με τον μηχανισμό τους.
SN 1 Αντιδράσεις
Το σύμβολο "S" αναφέρεται σε "υποκατάσταση" και "N" αναφέρεται σε "Πυρηνόφιλο". Ο αριθμός («1» εδώ) δείχνει την κινητική σειρά της αντίδρασης. Αυτές οι αντιδράσεις περιλαμβάνουν το σχηματισμό ενός ενδιάμεσου καρβοκατιόντος. Επομένως, η αντίδραση λαμβάνει χώρα σε δύο βήματα.
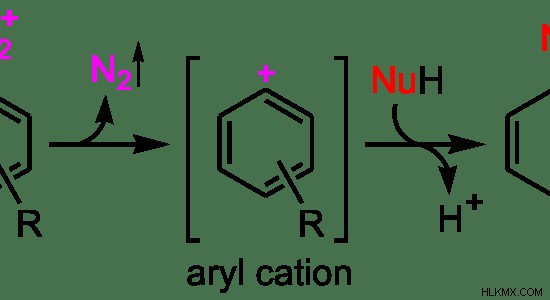
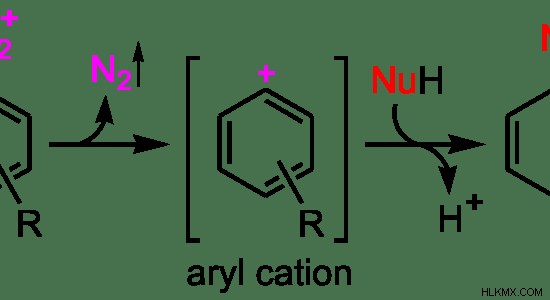
Εικόνα 3:Μηχανισμός αντίδρασης SN1
Στο παραπάνω παράδειγμα, N2 είναι η αποχωρούσα ομάδα του αρχικού μορίου. Ως πρώτο βήμα, η αποχωρούσα ομάδα φεύγει, σχηματίζοντας ένα ενδιάμεσο καρβοκατιόν. Το ενδιάμεσο που σχηματίζεται εδώ είναι ένα κατιόν αρυλίου. Δεδομένου ότι είναι ένα σταθερό ιόν, αυτό είναι το στάδιο που καθορίζει την ταχύτητα αυτής της αντίδρασης. Ως δεύτερο βήμα, το πυρηνόφιλο συνδέεται με το καρβοκατιόν.
SN 2 Αντιδράσεις
Στο SN 2 αντίδραση, δεν σχηματίζεται καρβοκατιόν. Επομένως η αντίδραση λαμβάνει χώρα σε ένα μόνο βήμα. Επομένως, είναι το βήμα που καθορίζει την ταχύτητα της αντίδρασης.
Εικόνα 4:Μηχανισμός αντίδρασης SN2
Το παραπάνω παράδειγμα δείχνει την αποχώρηση της αποχωρούσας ομάδας («Χ» εδώ) και την αντικατάσταση του Πυρηνόφιλου που συμβαίνει ταυτόχρονα. Διαβάστε περισσότερα:Διαφορά μεταξύ SN 1 και SN 2 Αντιδράσεις.
Τι είναι η Ηλεκτρόφιλη Αντίδραση Υποκατάστασης
Η ηλεκτρόφιλη υποκατάσταση είναι μια χημική αντίδραση που περιλαμβάνει τη μετατόπιση μιας λειτουργικής ομάδας από ένα ηλεκτρόφιλο. Τις περισσότερες φορές, τα άτομα υδρογόνου μετατοπίζονται με αυτόν τον τρόπο. Αντιδράσεις ηλεκτρόφιλης υποκατάστασης απαντώνται επίσης σε αλειφατικές και αρωματικές ενώσεις. Οι αντιδράσεις ηλεκτρόφιλης υποκατάστασης χρησιμοποιούνται ιδιαίτερα για την παραγωγή παραγώγων βενζολίου.
Τα ηλεκτρόφιλα είναι μόρια που είναι είτε θετικά φορτισμένα είτε ουδέτερα φορτισμένα αλλά στερούνται ηλεκτρονίων. Τα ηλεκτρόφιλα δέχονται ηλεκτρόνια από πυρηνόφιλα για να εξουδετερώσουν το φορτίο του ή να υπακούσουν στον κανόνα της οκτάδας και να γίνουν σταθερά.
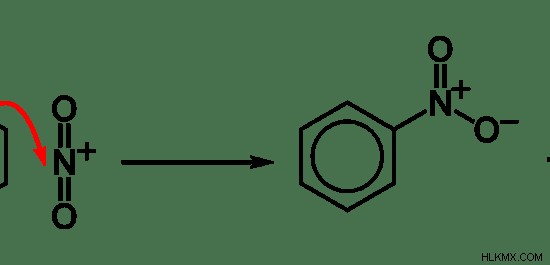
Εικόνα 5:Παράδειγμα αντίδρασης ηλεκτρόφιλης υποκατάστασης σε αρωματικές ενώσεις
Στο παραπάνω παράδειγμα, ένα άτομο υδρογόνου του δακτυλίου βενζολίου εκτοπίζεται κατά NO2 ιόν. Σε αυτήν την περίπτωση, ΟΧΙ2 είναι το ηλεκτρόφιλο. Υπάρχει θετικό φορτίο στο άτομο αζώτου. Ο δακτύλιος βενζολίου είναι πλούσιος σε ηλεκτρόνια λόγω της παρουσίας δεσμών pi. Ως εκ τούτου, το ηλεκτρόφιλο επιτίθεται στον δακτύλιο βενζολίου και συνδέεται με αυτόν, καθιστώντας ένα άτομο υδρογόνου την «αναχωρούσα ομάδα».
Οι αντιδράσεις Ηλεκτρόφιλης υποκατάστασης εντοπίζονται κυρίως σε δύο τύπους μηχανισμών.
SE 1 Αντιδράσεις
Αυτά τα SE 1 αντιδράσεις περιλαμβάνουν το σχηματισμό ενός καρβοκατιόντος που είναι σταθερό. Επομένως, το βήμα καθορισμού του ρυθμού είναι το στάδιο του σχηματισμού καρβοκατιόντος. Αυτό υποδηλώνει ότι το SE 1 αντιδράσεις συμβαίνουν σε δύο στάδια. Η προσκόλληση του ηλεκτροφίλου στο καρβοκατιόν μπορεί επίσης να παρατηρηθεί εδώ. Αλλά η αποχωρούσα ομάδα εξακολουθεί να είναι προσκολλημένη στο καρβοκατιόν. Ως δεύτερο βήμα, εμφανίζεται η αναχώρηση της αποχωρούσας ομάδας.
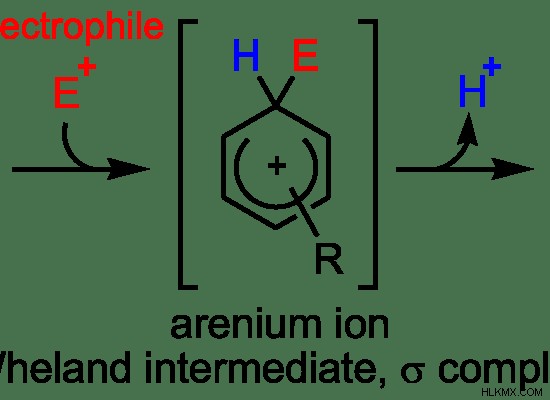
Εικόνα 6:Μηχανισμός αντίδρασης SE1
SE 2 Αντιδράσεις
Το SE 2 αντιδράσεις περιλαμβάνουν μόνο ένα βήμα. Δεν σχηματίζεται καρβοκατιόν. Επομένως, το βήμα καθορισμού του ρυθμού είναι ο σχηματισμός υποκατεστημένου μορίου.
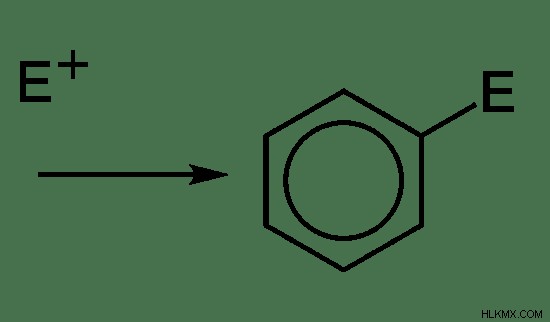
Εικόνα 7:Μηχανισμός αντίδρασης SE2
Ομοιότητες μεταξύ πυρηνόφιλης και αντίδρασης ηλεκτρόφιλης υποκατάστασης
-
Και οι δύο τύποι αντιδράσεων σχετίζονται με την κοινή χρήση ηλεκτρονίων.
-
Και οι δύο αντιδράσεις καταλήγουν σε ομοιοπολικούς δεσμούς.
-
Και οι δύο αντιδράσεις έχουν ως αποτέλεσμα μια μετατόπιση μιας ομάδας που υπάρχει στο μόριο του υποστρώματος.
-
Δημιουργούν ομάδες αποχώρησης.
-
Και οι δύο τύποι αντιδράσεων βρίσκονται σε χημικές αντιδράσεις που σχετίζονται με αλειφατικές και αρωματικές ενώσεις.
Διαφορά μεταξύ πυρηνόφιλης και αντίδρασης ηλεκτρόφιλης υποκατάστασης
Ορισμός
Αντίδραση πυρηνόφιλης υποκατάστασης: Η αντίδραση πυρηνόφιλης υποκατάστασης είναι μια χημική αντίδραση που περιλαμβάνει τη μετατόπιση μιας αποχωρούσας ομάδας από ένα πυρηνόφιλο.
Αντίδραση ηλεκτροφιλικής υποκατάστασης: Η ηλεκτροφιλική υποκατάσταση είναι μια χημική αντίδραση που περιλαμβάνει τη μετατόπιση μιας λειτουργικής ομάδας από ένα ηλεκτρόφιλο.
Κοινή χρήση ηλεκτρονίων
Αντίδραση πυρηνόφιλης υποκατάστασης: Στην αντίδραση πυρηνόφιλης υποκατάστασης, το πυρηνόφιλο δωρίζει τα ηλεκτρόνια του.
Αντίδραση ηλεκτροφιλικής υποκατάστασης: Στην αντίδραση ηλεκτρόφιλης υποκατάστασης, το ηλεκτρόφιλο δέχεται ηλεκτρόνια.
Ηλεκτρική φόρτιση
Αντίδραση πυρηνόφιλης υποκατάστασης: Στις αντιδράσεις πυρηνόφιλης υποκατάστασης, το πυρηνόφιλο είναι είτε αρνητικά φορτισμένο είτε ουδέτερα φορτισμένο και το μόριο που δέχεται ηλεκτρόνια είναι θετικά ή ουδέτερα φορτισμένο.
Αντίδραση ηλεκτροφιλικής υποκατάστασης: Στην αντίδραση ηλεκτρόφιλης υποκατάστασης, το ηλεκτρόφιλο είναι είτε θετικά φορτισμένο είτε ουδέτερα φορτισμένο και το μόριο που δίνει ηλεκτρόνια είτε αρνητικά είτε ουδέτερα φορτισμένο.
Συμπέρασμα
Οι πυρηνόφιλες και ηλεκτρόφιλες αντιδράσεις υποκατάστασης είναι θεμελιώδεις αντιδράσεις στην οργανική και ανόργανη χημεία. Η κύρια διαφορά μεταξύ πυρηνόφιλης και ηλεκτρόφιλης αντίδρασης υποκατάστασης είναι ότι η αντίδραση πυρηνόφιλης υποκατάστασης περιλαμβάνει τη μετατόπιση μιας αποχωρούσας ομάδας από ένα πυρηνόφιλο ενώ η αντίδραση ηλεκτρόφιλης υποκατάστασης περιλαμβάνει τη μετατόπιση μιας λειτουργικής ομάδας από ένα ηλεκτρόφιλο.
Εικόνα Ευγενική προσφορά:
1. «Υποκατάσταση μέσω βενζίνης» (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. “General Scheme for Base Catalyzed Nucleophilc Acyl Substitution” By Ckalnmals – Δική εργασία (CC BY-SA 3.0) μέσω Commons Wikimedia
3. «Μηχανισμός νιτροποίησης βενζολίου» Από τον Benjah-bmm27 – Ίδιο έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia
4. "Αρωματικός μηχανισμός SN1" (Δημόσιος Τομέας) μέσω Commons Wikimedia
5. “Mechanismus der Sn2 Reaktion-Seite001” By Poyraz 72 – Δικό έργο (CC BY-SA 3.0) μέσω Commons Wikimedia
6. "Μηχανισμός ιόντων αρενίου" (Δημόσιος Τομέας) μέσω Commons Wikimedia
Αναφορά:
1." Ηλεκτρόφιλη υποκατάσταση.» Τι είναι η ηλεκτροφιλική υποκατάσταση; Ν.π., ν.δ. Ιστός. Διαθέσιμο εδώ. 27 Ιουνίου 2017.
2.Hunt, Dr Ian R. «Nucleophilic substitution». Κεφάλαιο 8:Πυρηνόφιλη υποκατάσταση. Ν.π., ν.δ. Ιστός. Διαθέσιμο εδώ. 27 Ιουνίου 2017.
3."B. Τι είναι η πυρηνόφιλη υποκατάσταση;» LibreTexts Χημείας. Libretexts, 24 Ιουνίου 2016. Web. Διαθέσιμο εδώ. 27 Ιουνίου 2017.




