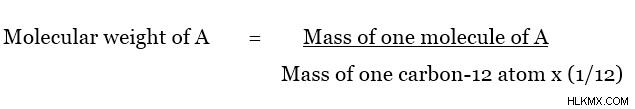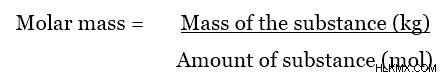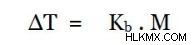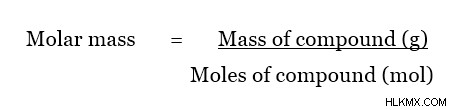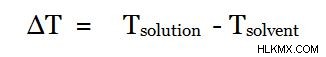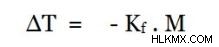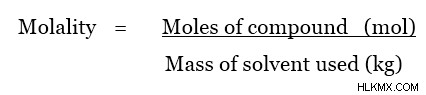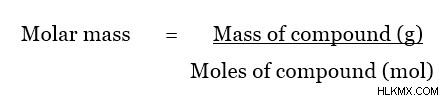Πώς να βρείτε τη μοριακή μάζα
Η μοριακή μάζα είναι μια σημαντική φυσική ιδιότητα των ουσιών. Είναι πολύ χρήσιμο για την ανάλυση, τη σύγκριση και την πρόβλεψη των άλλων φυσικών και χημικών ιδιοτήτων όπως η πυκνότητα, το σημείο τήξης, το σημείο βρασμού και η ποσότητα της ουσίας που αντιδρά με μια άλλη ουσία σε ένα σύστημα. Σε αυτό το άρθρο, θα συζητήσουμε πέντε διαφορετικές μεθόδους. χρησιμοποιώντας ατομικές μάζες, εξίσωση, ανύψωση σημείου βρασμού, πίεση σημείου πήξης και οσμωτική πίεση, για τον υπολογισμό της μοριακής μάζας.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η μοριακή μάζα
– Ορισμός, Εξίσωση για τον Υπολογισμό, Επεξήγηση
2. Πώς να βρείτε τη μοριακή μάζα
– Διάφορες μέθοδοι για τον υπολογισμό της μοριακής μάζας με παραδείγματα
3. Γιατί είναι σημαντικό να γνωρίζουμε τη μοριακή μάζα μιας ουσίαςς
– Εφαρμογές Μοριακής Μάζας
Βασικοί όροι:Αριθμός Avogadro, Ύψος σημείου βρασμού, Calusius-Clapeyron, Κρυοσκοπική σταθερά, Ebullioscopic Constant, Κατάθλιψη Σημείου Πήξης, Μοριακότητα, Μοριακή μάζα, Μοριακό Βάρος, Οσμωτική , Σχετική ατομική μάζα

Τι είναι Μοριακή Μάζα
Η μοριακή μάζα είναι η μάζα ενός mol μιας συγκεκριμένης ουσίας. Η πιο συχνά χρησιμοποιούμενη μονάδα για τη μοριακή μάζα μιας ουσίας είναι το gmol. Ωστόσο, η μονάδα SI για τη μοριακή μάζα είναι kgmol (ή kg/mol). Η μοριακή μάζα μπορεί να υπολογιστεί χρησιμοποιώντας την ακόλουθη εξίσωση.
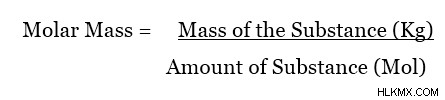
Mole ή mol είναι η μονάδα που χρησιμοποιείται για τη μέτρηση της ποσότητας μιας ουσίας. Ένα mole μιας ουσίας ισούται με έναν πολύ μεγάλο αριθμό, 6.023 x 10 ατόμων (ή μορίων) από τα οποία αποτελείται η ουσία. Αυτός ο αριθμός ονομάζεται αριθμός του Avogadro . Είναι σταθερά γιατί ανεξάρτητα από το είδος του ατόμου, ένα γραμμομόριο του είναι ίσο με αυτήν την ποσότητα ατόμων (ή μορίων). Επομένως, η μοριακή μάζα μπορεί να δοθεί ένας νέος ορισμός, δηλαδή, η μοριακή μάζα είναι η συνολική μάζα 6,023 x 10 ατόμων (ή μορίων) μιας συγκεκριμένης ουσίας. Για να αποφύγετε τη σύγχυση, ρίξτε μια ματιά στο παρακάτω παράδειγμα.
- Η ένωση Α αποτελείται από μόρια Α.
- Η ένωση Β αποτελείται από μόρια Β.
- Ένα mole της ένωσης Α αποτελείται από 6.023 x 10 μόρια Α.
- Ένα mole της ένωσης Β αποτελείται από 6.023 x 10 μόρια Β.
- Η μοριακή μάζα της ένωσης Α είναι το άθροισμα μαζών 6,023 x 10 μορίων Α.
- Η μοριακή μάζα της ένωσης Β είναι το άθροισμα μαζών 6,023 x 10 μορίων Β.
Τώρα μπορούμε να το εφαρμόσουμε για πραγματικές ουσίες. Ένα mole H2 Το O αποτελείται από 6,023 x 10 H2 Ω μόρια. Η συνολική μάζα 6,023 x 10 H2 Τα μόρια O είναι περίπου 18 g. Επομένως, η μοριακή μάζα του H2 Το O είναι 18 g/mol.
Πώς να βρείτε τη μοριακή μάζα
Η μοριακή μάζα μιας ουσίας μπορεί να υπολογιστεί χρησιμοποιώντας διάφορες μεθόδους.
- Μέθοδος 1:Χρήση ατομικών μαζών για τον υπολογισμό της μοριακής μάζας
- Μέθοδος 2:Χρήση της εξίσωσης για τον υπολογισμό της μοριακής μάζας
- Μέθοδος 3:Υπολογισμός της μοριακής μάζας από την ανύψωση του σημείου βρασμού
- Μέθοδος 4:Υπολογισμός της μοριακής μάζας από την κατάθλιψη του σημείου πήξης
- Μέθοδος 5:Υπολογισμός της μοριακής μάζας από την οσμωτική πίεση
Αυτές οι μέθοδοι αναλύονται λεπτομερώς παρακάτω.
1. Πώς να βρείτε τη μοριακή μάζα χρησιμοποιώντας ατομικές μάζες
Η μοριακή μάζα ενός μορίου μπορεί να προσδιοριστεί χρησιμοποιώντας ατομικές μάζες. Αυτό μπορεί να γίνει απλά με την προσθήκη μοριακών μαζών κάθε υπάρχοντος ατόμου. Η μοριακή μάζα ενός στοιχείου δίνεται όπως παρακάτω.
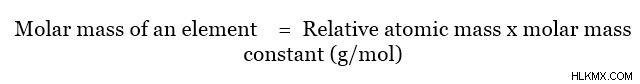
Η σχετική ατομική μάζα είναι η μάζα ενός ατόμου σε σχέση με τη μάζα του ατόμου άνθρακα-12 και δεν έχει μονάδες. Αυτή η σχέση μπορεί να δοθεί ως εξής.
Ας εξετάσουμε τα ακόλουθα παραδείγματα για να κατανοήσουμε αυτήν την τεχνική. Ακολουθούν οι υπολογισμοί για ενώσεις με το ίδιο άτομο, συνδυασμό πολλών διαφορετικών ατόμων και συνδυασμό μεγάλου αριθμού ατόμων.
Παραδείγματα υπολογισμού
1. Υπολογισμός της μοριακής μάζας του H2 και HCl
3. Μοριακή μάζα C6 H12 O6
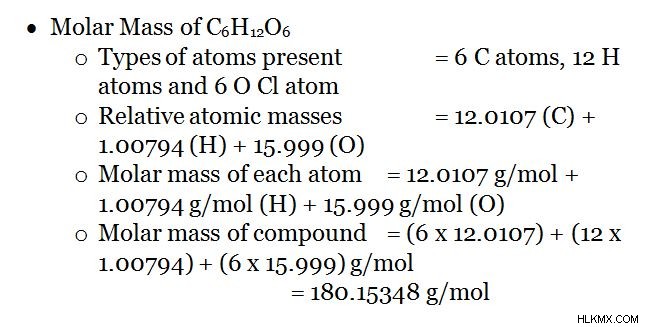
2. Πώς να βρείτε τη μοριακή μάζα χρησιμοποιώντας την εξίσωση
Η μοριακή μάζα μπορεί να υπολογιστεί χρησιμοποιώντας την εξίσωση που δίνεται παρακάτω. Αυτή η εξίσωση χρησιμοποιείται για τον προσδιορισμό μιας άγνωστης ένωσης.
Παράδειγμα υπολογισμού
Πάρτε το ακόλουθο παράδειγμα.
Η ένωση Δ βρίσκεται σε διάλυμα. Οι λεπτομέρειες δίνονται ως εξής.
- Η ένωση D είναι μια ισχυρή βάση.
- Μπορεί να απελευθερώσει ένα ιόν Η ανά μόριο.
- Το διάλυμα της ένωσης D παρασκευάστηκε χρησιμοποιώντας 0,599 g της ένωσης D.
- Αντιδρά με HCl σε αναλογία 1:1
Στη συνέχεια, ο προσδιορισμός μπορεί να γίνει με ογκομέτρηση οξέος-βάσης. Επειδή είναι ισχυρή βάση, τιτλοδοτήστε το διάλυμα με ισχυρό οξύ (π.χ. HCl, 1,0 mol/L) παρουσία δείκτη φαινολοφθαλεΐνης. Η αλλαγή χρώματος δείχνει το τελικό σημείο (π.χ.:όταν προστίθενται 15,00 mL HCl) της ογκομέτρησης και τώρα όλα τα μόρια της άγνωστης βάσης τιτλοδοτούνται με το προστιθέμενο οξύ. Στη συνέχεια, η μοριακή μάζα της άγνωστης ένωσης μπορεί να προσδιοριστεί ως εξής.
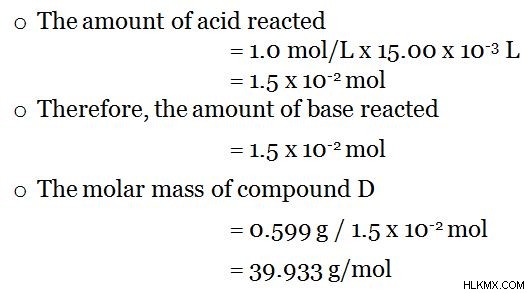
3. Πώς να βρείτε τη μοριακή μάζα από το υψόμετρο του σημείου βρασμού
Η ανύψωση του σημείου βρασμού είναι τα φαινόμενα που περιγράφουν ότι η προσθήκη μιας ένωσης σε έναν καθαρό διαλύτη θα αύξανε το σημείο βρασμού αυτού του μείγματος σε υψηλότερο σημείο βρασμού από αυτό του καθαρού διαλύτη . Επομένως, η μοριακή μάζα αυτής της προστιθέμενης ένωσης μπορεί να βρεθεί χρησιμοποιώντας τη διαφορά θερμοκρασίας μεταξύ δύο σημείων βρασμού. Εάν το σημείο βρασμού του καθαρού διαλύτη είναι Tδιαλύτης και το σημείο βρασμού του διαλύματος (με την προστιθέμενη ένωση) είναι Τδιάλυμα , η διαφορά μεταξύ δύο σημείων βρασμού μπορεί να δοθεί όπως παρακάτω.
Με τη χρήση της σχέσης Clausius-Clapeyron και το νόμο του Raoult, μπορούμε να πάρουμε μια σχέση μεταξύ ΔT και μοριακότητας του διαλύματος ως,
Πού, Kb είναι βολοσκοπική σταθερά, που εξαρτάται μόνο από τις ιδιότητες του διαλύτη, και M είναι η μοριακότητα.
Από την παραπάνω εξίσωση, μπορούμε να πάρουμε μια τιμή για τη μοριακότητα της λύσης. Καθώς η ποσότητα του διαλύτη που χρησιμοποιείται για την παρασκευή αυτού του διαλύματος είναι γνωστή, μπορούμε να βρούμε την τιμή για mole της ένωσης που προστέθηκε.
Τώρα που γνωρίζουμε τα mol της ένωσης στο διάλυμα και τη μάζα της ένωσης που προστέθηκε, μπορούμε να προσδιορίσουμε τη μοριακή μάζα της ένωσης χρησιμοποιώντας την εξίσωση,
4. Πώς να βρείτε τη μοριακή μάζα από την κατάθλιψη σημείου πήξης
Η κατάθλιψη του σημείου πήξης είναι το αντίθετο από την ανύψωση του σημείου βρασμού. Μερικές φορές, όταν μια ένωση προστίθεται σε έναν διαλύτη, το σημείο πήξης του διαλύματος μειώνεται από αυτό του καθαρού διαλύτη. Τότε οι παραπάνω εξισώσεις τροποποιούνται λίγο.
Η τιμή ΔT είναι μια τιμή μείον επειδή το σημείο βρασμού είναι τώρα χαμηλότερο από την αρχική τιμή. Η μοριακότητα του διαλύματος μπορεί να ληφθεί με τον ίδιο τρόπο όπως στη μέθοδο ανύψωσης του σημείου βρασμού.
Εδώ, το Kf είναι γνωστή ως η κρυοσκοπική σταθερά . Εξαρτάται μόνο από τις ιδιότητες του διαλύτη.
Οι υπόλοιποι υπολογισμοί είναι οι ίδιοι όπως στη μέθοδο ανύψωσης σημείου βρασμού. Εδώ, τα mol της ένωσης που προστίθεται μπορούν επίσης να υπολογιστούν χρησιμοποιώντας την παρακάτω εξίσωση.
Στη συνέχεια, η μοριακή μάζα μπορεί να υπολογιστεί χρησιμοποιώντας την τιμή για τα mol της ένωσης που προστέθηκε και τη μάζα της ένωσης που προστέθηκε.
5. Πώς να βρείτε τη μοριακή μάζα από την ωσμωτική πίεση
Η ωσμωτική πίεση είναι η πίεση που απαιτείται για να αποφευχθεί η διέλευση ενός καθαρού διαλύτη σε ένα δεδομένο διάλυμα με όσμωση. Η οσμωτική πίεση μπορεί να δοθεί από την ακόλουθη εξίσωση.
Π =MRT
Όταν Π είναι η ωσμωτική πίεση,
M είναι η μοριακότητα του διαλύματος
R είναι η καθολική σταθερά αερίου
T είναι η θερμοκρασία
Η μοριακότητα του διαλύματος δίνεται από την ακόλουθη εξίσωση.
Ο όγκος του διαλύματος μπορεί να μετρηθεί και η μοριακότητα να υπολογιστεί όπως παραπάνω. Επομένως, τα mol της ένωσης στο διάλυμα μπορούν να μετρηθούν. Στη συνέχεια, η μοριακή μάζα μπορεί να προσδιοριστεί χρησιμοποιώντας την εξίσωση,
Γιατί είναι σημαντικό να γνωρίζετε τη μοριακή μάζα μιας ουσίας
- Οι μοριακές μάζες διαφορετικών ενώσεων μπορούν να χρησιμοποιηθούν για τη σύγκριση των σημείων τήξης και των σημείων βρασμού αυτών των ενώσεων.
- Η μοριακή μάζα χρησιμοποιείται για τον προσδιορισμό των ποσοστών μάζας των ατόμων που υπάρχουν σε μια ένωση.
- Η μοριακή μάζα είναι πολύ σημαντική στις χημικές αντιδράσεις για να μάθουμε τις ποσότητες ενός συγκεκριμένου αντιδραστηρίου που έχει αντιδράσει ή να βρούμε την ποσότητα του προϊόντος που μπορεί να ληφθεί.
- Η γνώση των μοριακών μαζών είναι πολύ σημαντική πριν σχεδιαστεί μια πειραματική διάταξη.
Σύνοψη
Υπάρχουν διάφορες μέθοδοι για τον υπολογισμό της μοριακής μάζας μιας δεδομένης ένωσης. Ο ευκολότερος τρόπος μεταξύ αυτών είναι η προσθήκη μοριακών μαζών στοιχείων που υπάρχουν σε αυτήν την ένωση.