Διαφορά μεταξύ θείου και θειικού άλατος
Κύρια διαφορά – Θείο vs Θειικό
Η αφθονία θείου στη γη έχει προσδιοριστεί σε 0,042%. Αν και είναι πολύ μικρή σε σύγκριση με στοιχεία όπως το οξυγόνο και το πυρίτιο, είναι το 13 πιο άφθονο στοιχείο στη γη. Το θειικό είναι ένα ανιόν που αποτελείται από ένα άτομο θείου. Αλλά υπάρχει μια σαφής διαφορά μεταξύ θείου και θειικού. Η κύρια διαφορά μεταξύ θείου και θειικού είναι ότι το θείο είναι ένα στοιχείο ενώ το θειικό είναι ένα ανιόν.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το θείο
– Χημικές και φυσικές ιδιότητες, αλλότροπα
2. Τι είναι το Sulfate
– Χημικές και φυσικές ιδιότητες
3. Ποια είναι η διαφορά ανάμεσα στο θείο και το θειικόι
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αλλότροπα, μη μέταλλο, μονοκλινικό θείο, Ορθορομβικό θείο, Ρομβικό θείο, πυρίτιο, θειικό, θείο, σθένος 
Τι είναι το θείο
Το θείο είναι ένα στοιχείο. Ο ατομικός αριθμός του θείου είναι 16 με σύμβολο "S" και η διάταξη ηλεκτρονίων του θείου είναι 1s2s2p3s3p. Το εξώτατο ηλεκτρόνιο που περιέχει τροχιακό αυτού του στοιχείου είναι το p τροχιακό. Επομένως, το θείο ομαδοποιείται σε μπλοκ p. Σύμφωνα με τη διαμόρφωση ηλεκτρονίων του θείου, το σθένος του θείου είναι 6. Αυτό σημαίνει ότι μπορεί να σχηματίσει το πολύ 6 δεσμούς γύρω του. Έτσι, το θείο μπορεί να έχει καταστάσεις οξείδωσης έως +6. Αλλά μερικές φορές, το θείο μπορεί να αποκτήσει δύο ακόμη ηλεκτρόνια για να γεμίσει τα τροχιακά του p και στη συνέχεια να λάβει την κατάσταση οξείδωσης -2.
Κανονικά, το θείο βρίσκεται ως στερεό σε θερμοκρασία δωματίου. Αλλά αυτό το στερεό δεν περιέχει καθαρά άτομα θείου. Τις περισσότερες φορές, το στερεό θείου αποτελείται από S8 μονάδες. Αυτοί ονομάζονται κρύσταλλοι θείου. Ένα S8 Η μονάδα αποτελείται από 8 άτομα θείου. Είναι μια κυκλική δομή και είναι πολύ σταθερή. Το συμπαγές θείο εμφανίζεται σε έντονο κίτρινο χρώμα.

Εικόνα 1:Κρύσταλλοι θείου
Το σημείο τήξης του θείου είναι περίπου 115 C. Η ατομική μάζα του θείου είναι 32 g/mol. Το θείο είναι ένα αμέταλλο. Το στερεό θείου είναι μια εύθραυστη δομή αφού αποτελείται από κρυστάλλους. Ωστόσο, το θείο είναι αδιάλυτο στο νερό.
Το θείο έχει έναν αριθμό αλλοτρόπων. Αυτά τα αλλότροπα του θείου διαφέρουν μεταξύ τους ανάλογα με τη σύνθεσή τους σε άτομα θείου και τη δομή τους. Μερικά από τα κοινά αλλότροπα φαίνονται παρακάτω.
Αλλότροπα του θείου
Ορθορομβικό θείο
Το S8 Η μονάδα είναι σε δομή «στεφάνης».
Ρομβικό θείο
Αυτό είναι ένα σταθερό στερεό και αποτελείται από S8 μονάδες. Η γεωμετρία του S8 οι μονάδες είναι ρομβικές.
Μονοκλινικό θείο
Αυτές είναι δομές σε σχήμα βελόνας.
Ωστόσο, είναι εύκολο να ληφθεί ένα αλλοτρόπιο από ένα άλλο αλλοτρόπιο θερμαίνοντας το δείγμα του θείου αργά και σταθερά.
Τι είναι το Sulfate
Το θειικό είναι ένα ανιόν, που αποτελείται από ένα άτομο θείου και τέσσερα άτομα οξυγόνου. Το συνολικό φορτίο αυτού του ανιόντος είναι -2. Ο μοριακός τύπος για τα θειικά είναι SO4 . Εκεί, δύο άτομα οξυγόνου συνδέονται με το άτομο θείου μέσω διπλών δεσμών και άλλα δύο συνδέονται με το θείο μέσω απλών δεσμών. Η κατάσταση οξείδωσης του θείου στο θειικό είναι +6. Είναι η μέγιστη κατάσταση οξείδωσης που μπορεί να έχει το θείο. Επομένως, το θειικό δεν μπορεί να υποστεί αντιδράσεις οξείδωσης.
Ωστόσο, όταν τα μήκη δεσμών στο θειικό προσδιορίζονται πειραματικά, βρέθηκε ότι όλα τα μήκη δεσμών είναι τα ίδια. Επομένως, υποδεικνύει ότι το θειικό έχει δομές συντονισμού.
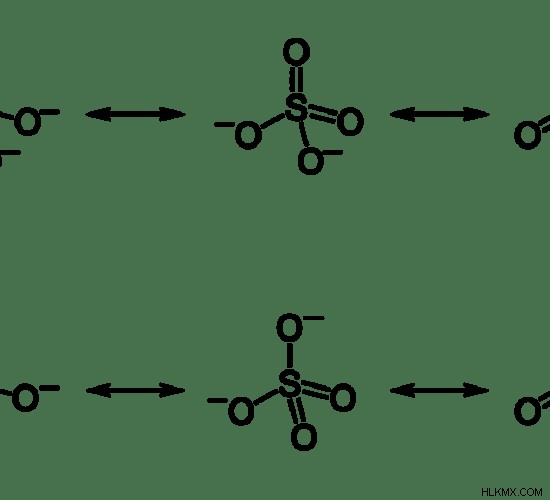
Εικόνα 2:Δομές συντονισμού θειικών ιόντων
Η μοριακή μάζα του θειικού ανιόντος είναι περίπου 96 g/mol. Οι περισσότερες θειικές ενώσεις είναι διαλυτές στο νερό. Αλλά η διαλυτότητα ορισμένων θειικών αλάτων είναι φτωχή ή δεν διαλύονται καθόλου. Για παράδειγμα, BaSO4 (θειικό βάριο) είναι αδιάλυτο στο νερό. Ορισμένες θειικές ενώσεις είναι άχρωμες ενώ κάποιες είναι πολύχρωμες όταν βρίσκονται στο νερό. Για παράδειγμα, CuSO4 (θειικός χαλκός) έχει έντονο μπλε χρώμα όταν βρίσκεται σε υδατικό διάλυμα αλλά έχει λευκό χρώμα απουσία μορίων νερού.
Διαφορά μεταξύ θείου και θειικού
Ορισμός
Θείο: Το θείο είναι ένα στοιχείο με το σύμβολο S.
θειικό: Το θειικό είναι ένα ανιόν, που αποτελείται από ένα άτομο θείου (S) και τέσσερα άτομα οξυγόνου (O).
Μάζα
Θείο: Η ατομική μάζα του θείου είναι περίπου 32 g/mol.
θειικό: Η μοριακή μάζα του θειικού είναι περίπου 96 g/mol.
Γεωμετρία
Θείο: Η γεωμετρία του θείου μπορεί να είναι ορθορομβική, ρομβική ή μονοκλινική.
θειικό: Η γεωμετρία του θειικού άλατος είναι τετραεδρική.
Σύνθεση
Θείο: Το στερεό θείο αποτελείται από S8 μονάδες.
θειικό: Το θειικό άλας αποτελείται από άτομα θείου και οξυγόνου.
Σημείο τήξης
Θείο: Το σημείο τήξης του θείου είναι περίπου 115 C.
θειικό: Το σημείο τήξης του θειικού εξαρτάται από το κατιόν που είναι δεσμευμένο σε αυτό.
Ηλεκτρική φόρτιση
Θείο: Το θείο είναι ουδέτερα φορτισμένο.
θειικό: Το θειικό είναι αρνητικά φορτισμένο.
Συμπέρασμα
Το άτομο θείου μπορεί να βρεθεί σε διάφορους τύπους ενώσεων ή ως αλλότροπα θείου. Τα αλλότροπα θείου αποτελούνται μόνο από άτομα θείου ενώ οι ενώσεις που περιέχουν θείο αποτελούνται από πολλά άλλα στοιχεία. Η κύρια διαφορά μεταξύ θείου και θειικού είναι ότι το θείο είναι ένα στοιχείο ενώ το θειικό είναι ένα ανιόν.




