Διαφορά μεταξύ θειικού και θειικού άλατος
Κύρια διαφορά – Θειικό έναντι Θειώδους
Όταν ένα ουδέτερο άτομο ή ένα μόριο αποκτά ηλεκτρόνια από έξω, γίνεται αρνητικά φορτισμένο είδος, καθώς τα ηλεκτρόνια είναι αρνητικά φορτισμένα και δεν υπάρχουν αρκετά θετικά φορτία για να εξουδετερώσουν το αρνητικό φορτίο. Όταν ένα ουδέτερα φορτισμένο άτομο ή ένα μόριο αποκτά ηλεκτρόνια, γίνεται ένα αρνητικά φορτισμένο είδος που ονομάζεται ανιόν. Τα θειικά και θειώδη είναι τέτοια ανιόντα. Η κύρια διαφορά μεταξύ θειικού και θειώδους είναι ότι τοθειικό αποτελείται από τέσσερα άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου ενώ το θειώδες αποτελείται από τρία άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Sulfate
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι το Sulfite
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ θειικού και θειώδους άλατος
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ θειικού και θειώδους
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ανιόν, Οξυγόνο, Θειικό, Θειώδες, Θείο 
Τι είναι το Sulfate
Το θειικό είναι ένα ανιόν που αποτελείται από ένα άτομο θείου συνδεδεμένο με τέσσερα άτομα οξυγόνου γύρω του. Το φορτίο του θειικού ανιόντος είναι -2. Ο μοριακός τύπος του θειικού είναι SO4 . Το θειικό ανιόν είναι η συζευγμένη βάση του θειικού οξέος. Όταν το θειικό οξύ διαχωρίζεται στα ιόντα του, δίνεται θειικό ανιόν και ένα πρωτόνιο (Η).
Όταν εξετάζουμε τη σύνδεση μεταξύ ατόμου θείου και ατόμων οξυγόνου, δύο άτομα οξυγόνου συνδέονται μέσω διπλών δεσμών και άλλα δύο άτομα οξυγόνου συνδέονται μέσω απλών δεσμών. Αυτό συμβαίνει επειδή το άτομο θείου μπορεί να έχει το πολύ 6 δεσμούς γύρω του. Επομένως τα δύο αρνητικά φορτία φαίνονται στα άτομα οξυγόνου που είναι συνδεδεμένα με τον απλό δεσμό. Η κατάσταση οξείδωσης του ατόμου του θείου είναι +6 και η κατάσταση οξείδωσης κάθε ατόμου οξυγόνου είναι -2. Αλλά όταν προσδιορίζεται πειραματικά, τα μήκη δεσμών μεταξύ των ατόμων θείου και οξυγόνου είναι τα ίδια. Αυτό οφείλεται στα φαινόμενα που ονομάζονται συντονισμός. Λόγω της επικάλυψης τροχιακών ατόμων θείου και οξυγόνου, τα ηλεκτρόνια γύρω από αυτά τα άτομα αποτοπίζονται. Επομένως, το μήκος δεσμού μεταξύ ενός ατόμου θείου και ενός ατόμου οξυγόνου είναι ένα μήκος μεταξύ αυτού του απλού δεσμού S-O και του διπλού δεσμού S=O. Το πραγματικό μήκος δεσμού έχει βρεθεί ως 149 μ.μ..
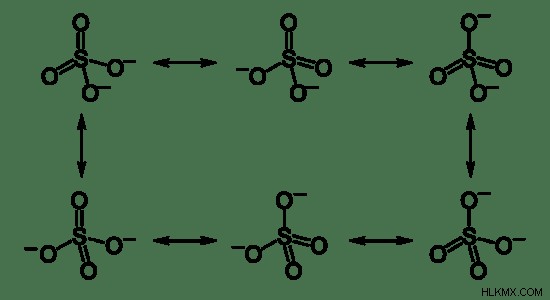
Εικόνα 1:Ο συντονισμός στο θειικό
Η μοριακή μάζα του θειικού ανιόντος είναι περίπου 96 g/mol. Κανονικά, το θειικό ανιόν είναι διαλυτό στο νερό. Αλλά ενώσεις όπως το θειικό ασβέστιο είναι ελάχιστα διαλυτές στο νερό. Η γεωμετρία γύρω από το άτομο του θείου είναι τετραεδρική και οι δεσμοί γύρω από το άτομο θείου θεωρούνται ότι είναι ίδιοι λόγω συντονισμού. Το θειώδες ανιόν δεν μπορεί να υποστεί οξείδωση επειδή το άτομο θείου βρίσκεται στην υψηλότερη δυνατή κατάσταση οξείδωσης.
Παραδείγματα μερικών κοινών θειικών αλάτων
- Baryte (BaSO4 )
- Anglesite (PbSO4 )
- Ανυδρίτης (CaSO4 )
- Γύψος (CaSO4 .2Η2 O)
- Εψωμίτης (MgSO4 .7H2 O)
Τι είναι το Sulfite
Το θειώδες είναι ένα ανιόν που αποτελείται από άτομα θείου και οξυγόνου. Το θειώδες ανιόν έχει ένα άτομο θείου συνδεδεμένο με τρία άτομα οξυγόνου. Το φορτίο του θειώδους ανιόντος είναι -2. Στο θειώδες ανιόν, ένα άτομο οξυγόνου συνδέεται με το θείο μέσω ενός διπλού δεσμού και άλλα δύο άτομα οξυγόνου συνδέονται με το άτομο θείου μέσω απλών δεσμών. Ωστόσο, τα μήκη δεσμού γύρω από το άτομο θείου είναι τα ίδια και η τιμή του μήκους του δεσμού είναι μεταξύ του απλού δεσμού S-O και του διπλού δεσμού S=O. Αυτό οφείλεται στον συντονισμό της δομής. Επομένως, όλα τα ομόλογα θεωρούνται ίδια.
Εικόνα 2:Η δομή συντονισμού του θειώδους άλατος
Επιπλέον, το θειώδες ανιόν έχει ένα μόνο ζεύγος ηλεκτρονίων στο άτομο θείου. Η κατάσταση οξείδωσης του θείου στα θειώδη είναι +4 και η κατάσταση οξείδωσης κάθε ατόμου οξυγόνου είναι -2. Η μοριακή μάζα του θειώδους ανιόντος είναι περίπου 80 g/mol. Η γεωμετρία γύρω από το άτομο θείου στο θειώδες άλας είναι τριγωνική πυραμιδική γεωμετρία.
Θεώδη άλατα Na, K και NH4 είναι διαλυτά στο νερό. Αλλά τα περισσότερα άλλα θειώδη είναι αδιάλυτα στο νερό. Το θειώδες άλας μπορεί να υποστεί αντιδράσεις οξείδωσης επειδή το άτομο θείου στα θειώδη βρίσκεται σε κατάσταση οξείδωσης +4 και μπορεί να οξειδωθεί έως και +6 κατάσταση οξείδωσης.
Παραδείγματα μερικών κοινών θειωδών ενώσεων
- Θειώδης χαλκός (CuSO3 )
- Θειώδης ψευδάργυρος (ZnSO3 )
- Θειώδες μαγνήσιο (MgSO3 )
- Θειώδες κάλιο (K2 SO3 )
Ομοιότητες μεταξύ Sulfate and Sulfite
- Και τα δύο είναι ανιόντα που φέρουν αρνητικά φορτία
- Το συνολικό φορτίο του ανιόντος είναι -2 και για τα δύο ανιόντα.
- Και τα δύο ανιόντα αποτελούνται από ένα άτομο θείου και από άτομα οξυγόνου συνδεδεμένα με το άτομο θείου.
- Και τα δύο ανιόντα εμφανίζουν συντονισμό στις χημικές τους δομές
- Η κατάσταση οξείδωσης του οξυγόνου και στα δύο ανιόντα είναι -2.
- Το θείο και στα δύο είδη μπορεί να υποστεί αντιδράσεις αναγωγής.
Διαφορά μεταξύ θειικών και θειωδών
Ορισμός
θειικό: Το θειικό είναι ένα ανιόν που αποτελείται από ένα άτομο θείου συνδεδεμένο με τέσσερα άτομα οξυγόνου γύρω του.
Θειώδες: Το θειώδες είναι ένα ανιόν που αποτελείται από άτομα θείου και οξυγόνου.
Μοριακή μάζα
θειικό: Η μοριακή μάζα του θειικού είναι περίπου 96 g/mol.
Θειώδες: Η μοριακή μάζα του θειώδους είναι περίπου 80 g/mol.
Διαλυτότητα
θειικό: Τα περισσότερα θειικά είναι διαλυτά στο νερό.
Θειώδες: Τα περισσότερα θειώδη είναι αδιάλυτα στο νερό.
Γεωμετρία
θειικό: Η γεωμετρία γύρω από το άτομο του θείου είναι τετραεδρική σε θειικά άλατα.
Θειώδες: Η γεωμετρία γύρω από το άτομο του θείου είναι τριγωνική πυραμιδική σε θειώδη.
Κατάσταση οξείδωσης του θείου
θειικό: Η κατάσταση οξείδωσης του θείου στο θειικό είναι +6.
Θειώδες: Η κατάσταση οξείδωσης του θείου στα θειώδη είναι +4.
Αντιδράσεις οξείδωσης
θειικό: Το θειικό δεν μπορεί να υποστεί αντιδράσεις οξείδωσης.
Θειώδες: Τα θειώδη μπορεί να υποστούν αντιδράσεις οξείδωσης.
Συμπέρασμα
Τα θειικά και τα θειώδη έχουν πολλές ομοιότητες αλλά και διαφορές. Ωστόσο, και τα δύο αυτά είδη χρησιμοποιούνται συνήθως σε εργαστηριακές πρακτικές καθώς και σε βιομηχανίες. Η κύρια διαφορά μεταξύ θειικού και θειώδους είναι ότι, το θειικό αποτελείται από τέσσερα άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου, ενώ το θειικό αποτελείται από τρία άτομα οξυγόνου συνδεδεμένα με ένα άτομο θείου.




