Διαφορά μεταξύ του σημείου ισοδυναμίας και του τελικού σημείου
Κύρια διαφορά – Σημείο ισοδυναμίας έναντι σημείου τέλους
Οι μέθοδοι τιτλοδότησης χρησιμοποιούνται συχνά για τον προσδιορισμό και τον ποσοτικό προσδιορισμό των συστατικών σε ένα μείγμα διαλύματος. Κάποιες τιτλοδοτήσεις γίνονται μαζί με έναν δείκτη που είναι χρήσιμος για την ένδειξη του τέλους της χημικής αντίδρασης. Αυτή η ένδειξη δίνεται αλλάζοντας το χρώμα του συστήματος. Αλλά ορισμένα αντιδρώντα λειτουργούν ως δείκτες. Έτσι, οι δείκτες δεν χρησιμοποιούνται σε όλα τα συστήματα. Τα αποτελέσματα μιας ογκομέτρησης εξαρτώνται κυρίως από το άτομο που κάνει την τιτλοδότηση, καθώς διαφορετικά άτομα προσδιορίζουν το τελικό σημείο μιας ογκομέτρησης σε διαφορετικά σημεία. Ωστόσο, το τελικό σημείο δεν είναι το σημείο όπου τελειώνει η αντίδραση. Το τέλος της αντίδρασης δίνεται από το σημείο ισοδυναμίας. Το τελικό σημείο υποδεικνύει ότι έχει επιτευχθεί το σημείο ισοδυναμίας. Η κύρια διαφορά μεταξύ σημείου ισοδυναμίας και τελικού σημείου είναι ότι το σημείο ισοδυναμίας είναι το πραγματικό σημείο όπου τελειώνει η χημική αντίδραση ενώ τοτελικό σημείο είναι το σημείο όπου συμβαίνει η αλλαγή χρώματος στο σύστημα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Equivalence Point
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι το τελικό σημείο
– Ορισμός, Ιδιότητες, Παράδειγμα
3. Ποια είναι η διαφορά μεταξύ του σημείου ισοδυναμίας και του τελικού σημείου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Τελικό σημείο, Σημείο Ισοδυναμίας, Δείκτης, Μοριακότητα, Φαινολοφθαλεΐνη, Τιτλοδότηση 
Τι είναι το Equivalence Point
Σημείο ισοδυναμίας είναι το πραγματικό σημείο όπου τελειώνει η χημική αντίδραση σε ένα μείγμα τιτλοδότησης. Μια τιτλοδότηση γίνεται συχνά για να προσδιοριστεί η συγκέντρωση μιας ουσίας σε ένα υγρό. Εάν η ουσία είναι γνωστή, μπορούμε να χρησιμοποιήσουμε έναν τιτλοδοτητή (διάλυμα που χρησιμοποιείται για τον προσδιορισμό της συγκέντρωσης ενός συστατικού σε ένα υγρό μείγμα) με γνωστή συγκέντρωση που μπορεί να αντιδράσει με την ουσία. Ο τιτλοδοτητής ονομάζεται πρότυπο διάλυμα επειδή είναι γνωστή η ακριβής μοριακότητά του.
Για παράδειγμα, ας εξετάσουμε την αντίδραση μεταξύ NaOH και HCl. Αυτή είναι μια αντίδραση οξέος-βάσης. Ως τιτλοδότηση της συγκέντρωσης μπορούμε να χρησιμοποιήσουμε είτε NaOH είτε HCl. Ο τιτλοδοτητής τοποθετείται στην προχοΐδα και προστίθεται αργά στον τιτλοδόχο/αναλύτη μέχρις ότου συμβεί αλλαγή χρώματος στο μίγμα της αντίδρασης. Θα πρέπει να χρησιμοποιείται ένας δείκτης καθώς το NaOH ή το HCl δεν είναι αυτοδείκτες. Το σημείο όπου συμβαίνει μια αλλαγή χρώματος λαμβάνεται ως τελικό σημείο της ογκομέτρησης. Αλλά δεν είναι το σημείο ισοδυναμίας της αντίδρασης.
Εδώ, το σημείο ισοδυναμίας είναι το σημείο όπου όλα τα μόρια του HCl έχουν αντιδράσει με το NaOH (ή το σημείο όπου όλα τα μόρια του NaOH έχουν αντιδράσει με το HCl). Εδώ, τα mol του τιτλοδοτητή θα πρέπει να είναι ίσα με τα mol της άγνωστης αναλυόμενης ουσίας.
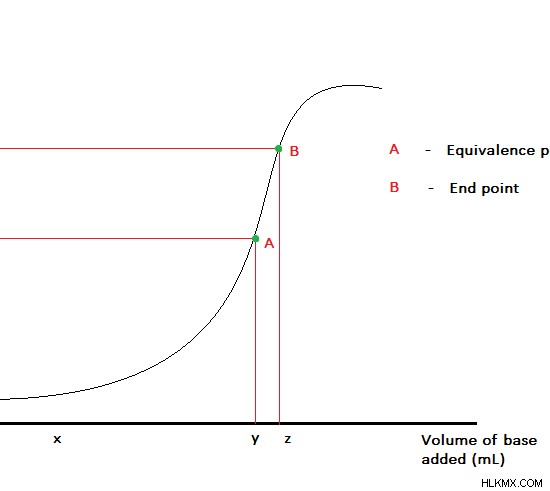
Εικόνα 1:Καμπύλη ογκομέτρησης για ογκομέτρηση ενός οξέος με βάση
Μέθοδοι προσδιορισμού του σημείου ισοδυναμίας
- Αλλαγή χρώματος αυτοδεικτών – Σε αντιδράσεις που περιλαμβάνουν αυτοδείκτες ως αντιδρώντα, η αλλαγή χρώματος υποδεικνύει το σημείο ισοδυναμίας της τιτλοδότησης, καθώς δεν χρησιμοποιούνται δείκτες.
- Τελικό σημείο – Μερικές φορές, το σημείο ισοδυναμίας μπορεί να θεωρηθεί ως το τελικό σημείο, καθώς είναι περίπου ίσα.
- Συμπεριφορά – Η αγωγιμότητα μπορεί επίσης να χρησιμοποιηθεί για τον προσδιορισμό του σημείου ισοδυναμίας της ογκομέτρησης. Εδώ, η αγωγιμότητα θα πρέπει να μετράται καθ' όλη τη διάρκεια της ογκομέτρησης και το σημείο ισοδυναμίας είναι το σημείο όπου συμβαίνει μια ταχεία αλλαγή αγωγιμότητας. Αυτή είναι λίγο δύσκολη μέθοδος.
- Φασματοσκοπία – Αυτή η μέθοδος μπορεί να χρησιμοποιηθεί για πολύχρωμα μείγματα αντίδρασης. Ο προσδιορισμός γίνεται σύμφωνα με την ταχεία αλλαγή στα μήκη κύματος που απορροφώνται από το δείγμα.
Τι είναι το τελικό σημείο
Το τελικό σημείο μιας ογκομέτρησης είναι το σημείο όπου συμβαίνει μια αλλαγή χρώματος. Κανονικά, τα οξέα και οι βάσεις είναι άχρωμα διαλύματα. Επομένως, για τον προσδιορισμό του τέλους της αντίδρασης εξουδετέρωσης ενός οξέος με μια βάση, χρησιμοποιείται ένας δείκτης που μπορεί να αλλάξει το χρώμα του μείγματος αντίδρασης με αλλαγές στο pH. Για παράδειγμα, η φαινολοφθαλεΐνη είναι ένας κοινός δείκτης που χρησιμοποιείται σε αντιδράσεις όξινης βάσης. Η αλλαγή χρώματος αυτού του δείκτη δίνεται σε 8,3 (άχρωμο) και 10,0 (ροζ). Αλλά αυτός ο δείκτης δεν είναι κατάλληλος για αντιδράσεις που συμβαίνουν σε χαμηλές τιμές pH. Επομένως, ο δείκτης θα πρέπει να επιλεγεί ανάλογα.

Εικόνα 2:Χρώμα φαινολοφθαλεΐνης σε διαφορετικές τιμές pH
Το τελικό σημείο δεν είναι το σημείο όπου η συνολική ποσότητα του αγνώστου έχει πλήρως αντιδράσει με τον τιτλοδοτητή. Σε αντιδράσεις όπου εμπλέκονται αυτοδείκτες, το τελικό σημείο δίνεται όταν ολόκληρη η ποσότητα του αγνώστου έχει αντιδράσει με τιτλοδότηση. Επομένως, το τελικό σημείο είναι ίσο με το σημείο ισοδυναμίας εδώ. Για παράδειγμα, η μισή αντίδραση μετατροπής του Cr2 O7 στο C αλλάζει το χρώμα του μέσου από πορτοκαλί σε πράσινο. Αυτό συμβαίνει γιατί το χρώμα του Cr (+6) στο υδατικό διάλυμα είναι πορτοκαλί και το χρώμα του Cr (+3) στο υδατικό διάλυμα είναι πράσινο. Επομένως, αυτή η αλλαγή χρώματος λαμβάνεται ως τελικό σημείο αυτής της αντίδρασης.
Διαφορά μεταξύ του σημείου ισοδυναμίας και του τελικού σημείου
Ορισμός
Σημείο ισοδυναμίας: Το σημείο ισοδυναμίας είναι το πραγματικό σημείο όπου τελειώνει η χημική αντίδραση στο μείγμα τιτλοδότησης.
Τελικό σημείο: Το τελικό σημείο μιας ογκομέτρησης είναι το σημείο όπου συμβαίνει μια αλλαγή χρώματος.
Στοιχειομετρία
Σημείο ισοδυναμίας: Το σημείο ισοδυναμίας δίνει το σημείο όπου η άγνωστη αναλυόμενη ουσία έχει πλήρως αντιδράσει με τον τιτλοδοτητή.
Τελικό σημείο: Το τελικό σημείο δεν δίνει πάντα το σημείο όπου η άγνωστη αναλυόμενη ουσία έχει πλήρως αντιδράσει με τον τιτλοδοτητή.
Αλλαγή χρώματος
Σημείο ισοδυναμίας: Η αλλαγή χρώματος του μείγματος αντίδρασης δεν υποδεικνύει πάντα το ακριβές σημείο ισοδυναμίας.
Τελικό σημείο: Η αλλαγή χρώματος δείχνει πάντα το τελικό σημείο.
Τέλος αντίδρασης
Σημείο ισοδυναμίας: Το σημείο ισοδυναμίας δίνει το σημείο στο οποίο τελειώνει η αντίδραση.
Τελικό σημείο: Το τελικό σημείο δεν δίνει πάντα μόνο το τέλος της αντίδρασης.
Συμπέρασμα
Αν και το τελικό σημείο θεωρείται συνήθως ως το σημείο ισοδυναμίας, δεν είναι το ίδιο. Αλλά επειδή υπάρχει μόνο μια μικρή διαφορά μεταξύ ισοδύναμου σημείου και τελικού σημείου και μπορεί να θεωρηθεί το ίδιο για εργαστηριακές πρακτικές. Το τελικό σημείο έρχεται πάντα μετά το σημείο ισοδυναμίας. Η κύρια διαφορά μεταξύ του σημείου ισοδυναμίας και του τέλους είναι ότι το σημείο ισοδυναμίας είναι το τέλος της αντίδρασης ενώ το τελικό σημείο είναι το σημείο όπου συμβαίνει μια αλλαγή χρώματος.