5 Θεμελιώδεις ιδιότητες των μη μετάλλων
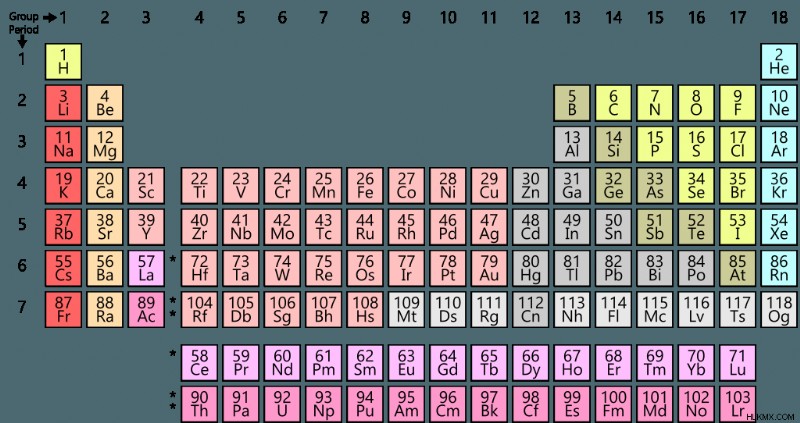
Στη χημεία, ο όρος «μη μέταλλο» αναφέρεται σε στοιχεία και ενώσεις που στερούνται μεταλλικού χαρακτήρα. Παρά το γεγονός ότι αποτελούν μόνο 17 από τα 118 γνωστά στοιχεία, τα αμέταλλα είναι μερικά από τα πιο σημαντικά στοιχεία που είναι απαραίτητα για τη ζωή όπως τη γνωρίζουμε. Παραδείγματα μη μετάλλων περιλαμβάνουν άνθρακα, οξυγόνο, άζωτο και υδρογόνο. τα οποία είναι όλα τα βασικά δομικά στοιχεία των οργανικών ενώσεων.
Σε σύγκριση με τα μέταλλα, τα αμέταλλα εμφανίζουν ένα εξαιρετικά μεταβλητό φάσμα ιδιοτήτων, όσον αφορά την ατομική και χημική τους συμπεριφορά. Αυτό οφείλεται στο γεγονός ότι τα αμέταλλα διαφέρουν ευρέως ως προς τις αντοχές διατομικών και διαμοριακών δεσμών. Τα περισσότερα αμέταλλα τείνουν να είναι αέρια σε τυπικές θερμοκρασίες και πίεση και έχουν χαμηλές πυκνότητες. Όλα τα αμέταλλα βρίσκονται στα δεξιά του περιοδικού πίνακα στο μπλοκ p των στοιχείων (εκτός από το υδρογόνο). Οι ιδιότητες που παρατηρούνται συνήθως στα μη μέταλλα είναι:
- για ιοντικούς/ομοιοπολικούς δεσμούς
- εύθραυστο και μη εύπλαστο
- χαμηλά σημεία τήξης/βρασμού
- Υψηλή ενέργεια ιονισμού και ηλεκτραρνητικότητα
- κακοί αγωγοί θερμότητας και ηλεκτρισμού
Αυτή η λίστα ιδιοτήτων δεν είναι ούτε ουσιαστική ούτε εξαντλητική. Ορισμένα αμέταλλα έχουν όλες αυτές τις ιδιότητες, μερικά έχουν πολύ λίγες. Ο γραφίτης, για παράδειγμα, είναι μια μη μεταλλική ένωση που είναι πολύ καλός αγωγός του ηλεκτρισμού και χρησιμοποιείται σε ηλεκτρονικό εξοπλισμό. Τα πολυμερή όπως το πλαστικό είναι αλυσίδες μορίων με ομοιοπολικό δεσμό που είναι εύπλαστα και μπορούν να διαμορφωθούν.
Είδη μη μετάλλων
Γενικά, τα αμέταλλα χωρίζονται σε δύο κατηγορίες: αντιδραστικά αμέταλλα και αλογόνα . Τα δραστικά αμέταλλα τείνουν να παρουσιάζουν μεγαλύτερη διαφοροποίηση στις φυσικές και χημικές τους ιδιότητες. Μερικά, όπως ο άνθρακας και το θείο, είναι στερεά σε θερμοκρασία δωματίου και είναι λιγότερο ηλεκτραρνητικά. Άλλα, όπως το οξυγόνο, είναι αέριο σε θερμοκρασία δωματίου και είναι πολύ ηλεκτραρνητικά. Τα δραστικά αμέταλλα περιλαμβάνουν επίσης τα αλογόνα—στοιχεία της ομάδας 17 των περιοδικών πινάκων. Όλα τα αλογόνα έχουν μια στιβάδα σθένους 7 ηλεκτρονίων, επομένως είναι εξαιρετικά αντιδραστικά και σχηματίζουν εύκολα αρνητικά ιόντα. Τα διαφορετικά δραστικά αμέταλλα είναι:
- Υδρογόνο (H)
- Άνθρακας (C)
- Άζωτο (Ν)
- Οξυγόνο (O)
- Φώσφορος (P)
- Θείο (S)
- Σελήνιο (Se)
Τα αλογόνα είναι:
- Φθόριο (F)
- Χλώριο (Cl)
- Βρώμιο (Β)
- Ιώδιο (Ι)
- Αστατίνη (ως)
Αντίθετα, τα ευγενή αέρια χαρακτηρίζονται από την αδρανή χημική τους συμπεριφορά. Τα ευγενή αέρια έχουν ένα κέλυφος πλήρους σθένους 8 ηλεκτρονίων, επομένως υπάρχουν σε μια πολύ σταθερή διαμόρφωση ηλεκτρονίων. Ως εκ τούτου, τα ευγενή αέρια τυπικά δεν αντιδρούν με άλλα στοιχεία για να σχηματίσουν ενώσεις. Τα ευγενή αέρια είναι:
- Ήλιο (Αυτός)
- Νέον (Ne)
- Αργόν (Ar)
- Krypton (Kr)
- Xenon (Xe)
- Ραδόνιο (Rn)
- στοιχείο 118 (oganesson Og)
5 Ιδιότητες μη μετάλλων
1. Σχηματίστε ομοιοπολικούς/ιονικούς δεσμούς
Ένα από τα κύρια χαρακτηριστικά των μη μετάλλων είναι ότι σχηματίζουν χημικές ενώσεις δημιουργώντας ομοιοπολικούς και ιοντικούς δεσμούς. Στους ομοιοπολικούς δεσμούς, δύο στοιχεία θα μοιράζονται ηλεκτρόνια σθένους μέχρι να αποκτήσουν ένα πλήρες κέλυφος. Οι κοινές καθημερινές ομοιοπολικές ενώσεις περιλαμβάνουν το διοξείδιο του άνθρακα, την αιθανόλη (αλκοόλη), τη γλυκόζη και τον τετραχλωράνθρακα. Τα στοιχεία σε ομοιοπολικές ενώσεις μοιράζονται ηλεκτρόνια έτσι ώστε το καθένα να μπορεί να επιτύχει μια σταθερή διαμόρφωση ηλεκτρονίων. Οι ομοιοπολικές ενώσεις τείνουν να παρουσιάζουν τη μεγαλύτερη διαφοροποίηση στη μοριακή τους γεωμετρία. Οι ομοιοπολικές ενώσεις θα λάβουν ένα σχήμα που ελαχιστοποιεί την ποσότητα της ηλεκτροστατικής απώθησης μεταξύ των ζευγών ηλεκτρονίων. Οι ομοιοπολικοί δεσμοί σχηματίζονται συνήθως μεταξύ δύο μη μετάλλων.
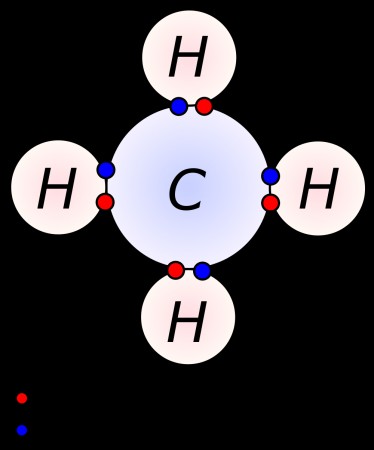
Αντίθετα, ιονικοί δεσμοί τείνουν να σχηματίζονται μεταξύ αμετάλλων και μετάλλων. Στους ιοντικούς δεσμούς, ένα στοιχείο παίρνει ηλεκτρόνια από ένα άλλο που δημιουργεί ένα κατιόν και ένα ανιόν. Τα αντίθετα φορτισμένα ιόντα έλκονται μεταξύ τους και συγκεντρώνονται για να σχηματίσουν ιοντικές ενώσεις. Οι κοινές ιοντικές ενώσεις περιλαμβάνουν επιτραπέζιο αλάτι, ανθρακικό, θειικό και χλωριούχο κάλιο. Οι ιονικοί δεσμοί τείνουν να σχηματίζονται μεταξύ στοιχείων που διαφέρουν πολύ σε ηλεκτραρνητικότητα (ΔEN> 2,0). Οι περισσότερες ιοντικές ενώσεις διατάσσονται σε μια περιοδική δομή ιόντων γνωστή ως πλέγμα.
2. Εύθραυστο
Οι περισσότερες ενώσεις ομοιοπολικές και ιοντικές ενώσεις που κατασκευάζονται από μη μέταλλα τείνουν να είναι εύθραυστες και θραύονται εάν ασκηθεί αρκετά μεγάλη δύναμη. Σε αντίθεση με τα μέταλλα, οι μη μεταλλικές ενώσεις δεν είναι εύπλαστες και όλκιμες. Οι περισσότερες μη μεταλλικές ενώσεις δεν μπορούν να παραμορφωθούν πέρα από ένα ορισμένο σημείο χωρίς να σπάσουν και θα χάσουν τη δύναμή τους όταν καλουπωθούν.

Οι μη μεταλλικές ενώσεις τείνουν να είναι εύθραυστες λόγω της φύσης των ιοντικών και ομοιοπολικών δεσμών τους. Τόσο οι ιονικοί όσο και οι ομοιοπολικοί δεσμοί συνεπάγονται την κοινή χρήση/σύλληψη ηλεκτρονίων. Και τα δύο είδη ενώσεων διατάσσονται με τέτοιο τρόπο ώστε να ελαχιστοποιούν τις ηλεκτροστατικές απωθήσεις. Για παράδειγμα, σε μια ιοντική ένωση, τα θετικά και αρνητικά άτομα κλειδώνονται στη θέση τους σε μια σφιχτή κρυσταλλική δομή με θετικά ιόντα ευθυγραμμισμένα με αρνητικά ιόντα. Η εφαρμογή μιας δύναμης μπορεί να μετατοπίσει την ευθυγράμμιση των ιόντων έτσι ώστε τα θετικά να ευθυγραμμίζονται με τα θετικά και τα αρνητικά με τα αρνητικά. Η απώθηση προκαλεί θραύση της ένωσης.
Ομοίως, οι ομοιοπολικοί δεσμοί απαιτούν τα ηλεκτρόνια και τα άτομα να διατάσσονται με συγκεκριμένο τρόπο. η εφαρμογή μιας μηχανικής δύναμης διαταράσσει αυτή τη διάταξη προκαλώντας τη θραύση της ένωσης. Αντίθετα, οι μεταλλικοί δεσμοί μπορούν να κινηθούν και να γλιστρήσουν ο ένας δίπλα στον άλλον λόγω των αποτοποθετημένων δεσμών ηλεκτρονίων τους. Αυτός είναι ο λόγος που τα μέταλλα είναι όλκιμα και ελατά, μπορούν να αλλάξουν την ατομική τους δομή χωρίς να σπάσουν τους χημικούς δεσμούς τους.
3. Χαμηλά σημεία τήξης/βρασμού
Δεν είναι αλήθεια ότι όλες οι μη μεταλλικές ενώσεις έχουν χαμηλά σημεία τήξης και σημεία βρασμού. Το αλάτι, για παράδειγμα, έχει σημείο τήξης 801 °C που είναι πολύ υψηλό. Ωστόσο, σε σύγκριση με τα μέταλλα, οι μη μεταλλικές ενώσεις έχουν σχετικά χαμηλά σημεία τήξης. Τα χαμηλά σημεία τήξης και βρασμού εξηγούν γιατί η πλειονότητα των μη μετάλλων είναι αέρια σε θερμοκρασία δωματίου.
Οι μη μεταλλικές ενώσεις, ειδικά οι ομοιοπολικές ενώσεις, έχουν χαμηλά σημεία τήξης και βρασμού λόγω των σχετικά αδύναμων διαμοριακών αλληλεπιδράσεων τους. Η συμπεριφορά φάσης μιας ουσίας καθορίζεται από την ισχύ των διαμοριακών δεσμών της. Τα μέταλλα έχουν πολύ υψηλά σημεία τήξης και βρασμού επειδή έχουν πολύ ισχυρές διαμοριακές έλξεις. Οι ομοιοπολικές ενώσεις, από την άλλη πλευρά, δεν έχουν ισχυρές διαμοριακές έλξεις. Αυτό οφείλεται στο γεγονός ότι τα περισσότερα ομοιοπολικά μόρια είναι ηλεκτρικά ουδέτερα και επομένως δεν προσελκύουν τους γείτονές τους, τουλάχιστον όχι στον βαθμό που το κάνουν τα μέταλλα.
Οι ιοντικές ενώσεις έχουν υψηλότερα σημεία τήξης/βρασμού από τις ομοιοπολικές ενώσεις, αλλά ακόμα μικρότερα από εκείνα των μετάλλων. Η θέρμανση μιας ιοντικής ένωσης αυξάνει την κινητική ενέργεια των σωματιδίων. πέρα από ένα ορισμένο όριο, η κινητική ενέργεια υπερνικά την ηλεκτροστατική έλξη και η δομή του πλέγματος διασπάται. Αντίθετα, τα μέταλλα έχουν πολύ υψηλά σημεία τήξης/βρασμού επειδή τα άτομά τους μπορούν να αλλάξουν θέσεις χωρίς να σπάσουν χημικούς δεσμούς.
4. Ενέργεια Υψηλού Ιονισμού/Ηλεκτραρνητικότητα
Τα μη μέταλλα τείνουν να έχουν υψηλές ενέργειες ιονισμού. Αυτό σημαίνει ότι είναι δύσκολο να αφαιρεθούν ηλεκτρόνια από άτομα μη μετάλλου. Τα μη μέταλλα έχουν υψηλές ενέργειες ιονισμού λόγω του πόσο μεγάλοι είναι οι πυρήνες τους σε σύγκριση με το πόσο γεμάτο είναι το κέλυφος των ηλεκτρονίων τους. Οι μεγάλοι, θετικά φορτισμένοι πυρήνες ατόμων όπως το οξυγόνο και το φθόριο προσελκύουν πολύ έντονα τα ηλεκτρόνια τους, γεγονός που καθιστά δύσκολη την αφαίρεσή τους.
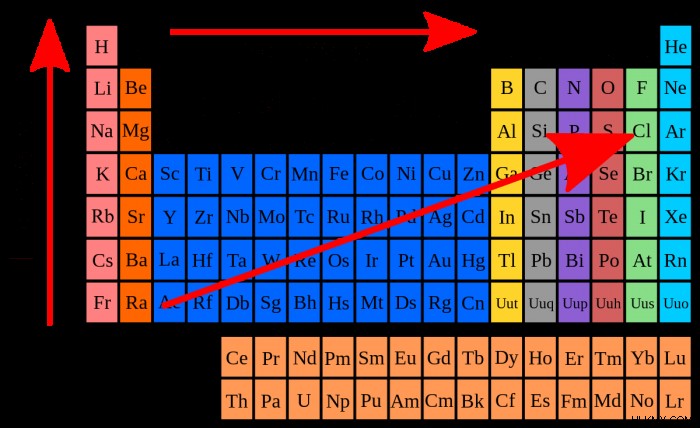
Ο ίδιος λόγος εξηγεί γιατί τα αμέταλλα τείνουν επίσης να είναι πιο ηλεκτραρνητικά από τα μέταλλα. Οι θετικά φορτισμένοι πυρήνες των μη μετάλλων ασκούν μια ισχυρή έλξη στα ηλεκτρόνια, αρκετά ισχυρή ώστε μερικές φορές να τα απομακρύνει από γειτονικά άτομα. Σε γενικές γραμμές, όσο πιο αριστερά πηγαίνει κανείς στον περιοδικό πίνακα, τόσο υψηλότερες ενέργειες ιονισμού και ηλεκτραρνητικότητα γίνονται.
5. Κακοί αγωγοί θερμότητας και ηλεκτρισμού
Τα αμέταλλα τείνουν επίσης να είναι σχετικά φτωχοί αγωγοί θερμότητας και ηλεκτρισμού, αν και υπάρχουν ορισμένες εξαιρέσεις. Ο λόγος για τον οποίο τα αμέταλλα είναι κακοί αγωγοί σχετίζεται με τον λόγο για τον οποίο τα μέταλλα είναι συγκριτικά καλοί αγωγοί. Τα μέταλλα μεταφέρουν καλά τη θερμότητα επειδή μπορούν να απορροφήσουν πολλή κινητική ενέργεια χωρίς να σπάσουν τους δεσμούς τους. Τα αμέταλλα, αντίθετα, χρειάζονται μια σταθερή διάταξη ατόμων για να παραμείνουν σταθερά, επομένως υπερβολική κινητική ενέργεια θα υπερνικήσει τους δεσμούς τους. Τα μέταλλα είναι καλοί αγωγοί του ηλεκτρισμού επειδή έχουν πολλά ανοιχτά τροχιακά μέσα στα οποία μπορούν να κινηθούν τα ηλεκτρόνια. Τα μη μέταλλα τείνουν να έχουν πλήρη τροχιακά, επομένως τα ηλεκτρόνια δεν έχουν πού να πάνε όταν εισάγονται σε μια τάση.
Η περίεργη περίπτωση του υδρογόνου:μέταλλο ή μη μέταλλο;
Γενικά, το πρώτο κιόλας στοιχείο υδρογόνο ταξινομείται ως μη μέταλλο. Ωστόσο, το υδρογόνο έχει ένα πολύ μοναδικό μείγμα ιδιοτήτων που καθιστούν δύσκολο να ταξινομηθεί ως μέταλλο ή μη μέταλλο. Για παράδειγμα, το υδρογόνο εμπλέκεται σε ομοιοπολικούς δεσμούς και υπάρχει φυσικά ως αέριο, όπως ένα μη μέταλλο. Ωστόσο, το υδρογόνο απορρίπτει επίσης εύκολα το μοναδικό του ηλεκτρόνιο για να σχηματίσει θετικά φορτισμένα ιόντα, μια ιδιότητα που παρατηρείται κυρίως στα μέταλλα. Ο μοναδικός συνδυασμός ιδιοτήτων του υδρογόνου είναι αποτέλεσμα της πολύ απλής ατομικής δομής του.
Το 1935, οι φυσικοί Eugene Wigner και Hillard Huntington προέβλεψαν ότι σε εξαιρετικά υψηλές θερμοκρασίες και πιέσεις, το υδρογόνο θα συμπυκνωθεί σε ένα μεταλλικό υγρό ή στερεό. Αυτή η εξωτική φάση του υδρογόνου προβλέπεται να συμπεριφέρεται σαν μέταλλο και να είναι πολύ καλός αγωγός της θερμότητας και του ηλεκτρισμού. Μέχρι στιγμής, το υδρογόνο έχει παρατηρηθεί να υπάρχει μόνο στην αέρια του κατάσταση, αν και πιστεύεται ότι υγρό μεταλλικό υδρογόνο μπορεί να υπάρχει στους πυρήνες αέριων γιγάντων πλανητών όπως ο Δίας ή ο Κρόνος. Ένας πυκνός πυρήνας υγρού μεταλλικού υδρογόνου θα εξηγούσε τα εξαιρετικά ισχυρά μαγνητικά πεδία των γιγάντων αερίων που έρχονται σε αντίθεση με τις κλασικές προβλέψεις.
Συνοψίζοντας, ένα μη μέταλλο είναι μια χημική ουσία που χαρακτηρίζεται από έλλειψη μεταλλικών ιδιοτήτων. Τα αμέταλλα είναι τυπικά αέρια ή υγρά σε θερμοκρασία δωματίου και διαιρούνται μεταξύ των αντιδρώντων αμέταλλων και των ευγενών αερίων. Τα μη μέταλλα εμπλέκονται σε ομοιοπολικούς δεσμούς, σχηματίζουν εύθραυστες εύθραυστες ενώσεις, έχουν χαμηλά σημεία τήξης/βρασμού, έχουν υψηλές ενέργειες ιονισμού και ηλεκτραρνητικότητα και είναι κακοί αγωγοί του ηλεκτρισμού. Τα αμέταλλα είναι πιο χημικά μεταβλητά από τα μέταλλα λόγω του σχετικά μεγάλου εύρους μεγεθών ατομικών πυρήνων και διαμορφώσεων ηλεκτρονίων. Όλα τα αμέταλλα βρίσκονται στο μπλοκ p του περιοδικού πίνακα.




