Ποια είναι η διαφορά μεταξύ ενός μορίου και μιας ένωσης;
Αν και υπάρχει ακόμη κάποια συζήτηση σχετικά με την επίσημη διάκριση, ένα μόριο είναι μια ομάδα δύο ή περισσότερων ατόμων που ενώνονται με χημικούς δεσμούς, ενώ μια ένωση είναι μια ουσία που σχηματίζεται από το χημικό δεσμό περισσότερων του ενός τύπων στοιχείων που υπάρχουν σε μια σταθερή αναλογία. Οι μοριακές ενώσεις και οι ιοντικές ενώσεις διαφέρουν ως προς τους τύπους δεσμών που περιέχει το καθένα.
Αν κλείσετε τα μάτια σας και σκεφτείτε την επιστήμη του γυμνασίου, πιθανότατα θα θυμάστε ακόμα τον δάσκαλό σας να συζητά ασταμάτητα για μόρια και ενώσεις στο μάθημα της χημείας σας. Μπορεί να μην είναι μια ευχάριστη ανάμνηση και μπορεί να μην θυμάστε τι προσπαθούσε να εξηγήσει, αλλά τα μόρια αποτελούν το σύνολο της ύπαρξής μας, επομένως μια σύντομη ανασκόπηση της ορολογίας που περιβάλλει τα μόρια και τις ενώσεις είναι πιθανώς καλή.

Μάθημα χημείας (Φωτογραφία :Elegant Solution/Shutterstock)
Όταν βλέπετε ένα μοριακό διάγραμμα ή διαβάζετε έναν μοριακό τύπο, μπορεί να μην είναι αμέσως εμφανές εάν βλέπετε ένα μόριο ή μια ένωση. Στην πραγματικότητα, μπορεί να μην γνωρίζετε καν αν υπάρχει καθόλου διαφορά μεταξύ αυτών των δύο ονομασιών! Για να το θέσω απλά, όλες οι ενώσεις είναι μόρια, αλλά δεν είναι όλα τα μόρια ενώσεις. Αν αυτό σας φαίνεται σαν ένα πειράγμα εγκεφάλου, συνεχίστε να διαβάζετε για λίγο περισσότερες λεπτομέρειες.
Μόρια εναντίον Ενώσεων
Οι λέξεις "μόριο" και "ένωση" αναμιγνύονται πολύ τυχαία, συχνά εναλλακτικά, σε οποιαδήποτε συζήτηση σχετικά με τη χημεία ή τις επιστήμες των υλικών. Υπάρχει ένας καλός λόγος για αυτό—οι επίσημοι ορισμοί είναι πολύ διαφορετικοί και υπάρχει κάποια επικάλυψη, καθώς και συζήτηση σχετικά με τα όρια κάθε ταξινόμησης.
Μόρια
Με απλά λόγια, τα μόρια είναι σωματίδια που αποτελούνται από δύο ή περισσότερα άτομα που συγκρατούνται χημικά μεταξύ τους. αυτά τα μόρια έχουν συγκεκριμένο αριθμό ατομικών πυρήνων και μπορούν να θεωρηθούν μεμονωμένο σωματίδιο. Είτε ένα σωματίδιο αποτελείται από έναν μόνο τύπο ατόμου είτε από μια ποικιλία διαφορετικών ατόμων, εξακολουθεί να θεωρείται μόριο. Υπάρχουν μικρά μόρια και μεγάλα μόρια, που κυμαίνονται από το πιο βασικό μόριο Η2, που περιέχει μόνο δύο άτομα υδρογόνου, έως ένα σύνθετο μακρομόριο DNA, το οποίο αποτελείται από εκατομμύρια ζεύγη βάσεων και άτομα, «μόριο» είναι μια λέξη που ισχύει για μια τεράστια ποικιλία των σωματιδίων.

Μόριο υδρογόνου (H2) (Πιστωτική φωτογραφία :LoopAll/Shutterstock)
Ωστόσο, αν κοιτούσατε έναν κόκκο αλατιού, που αποτελείται καθαρά από NaCl, δεν θα τον θεωρούσατε μόριο, καθώς είναι στην πραγματικότητα ένα τεράστιο δίκτυο πλέγματος μεμονωμένων σωματιδίων ένωσης χλωριούχου νατρίου, χωρίς σαφή αριθμό ατομικών πυρήνες. Το ίδιο ισχύει αν κοιτάξεις μια σταγόνα νερό. δεν κοιτάτε ένα μόριο νερού, αλλά μάλλον μια τεράστια ομάδα υγρών μορίων H2O σε αρκετά υψηλή συγκέντρωση ώστε να είναι ορατή με γυμνό μάτι!

Τώρα, στο παρελθόν, τα μόρια έχουν οριστεί ως εκείνα τα σωματίδια που συνδέονταν αποκλειστικά μέσω ομοιοπολικών δεσμών, που σημαίνει δεσμός που συμβαίνει μέσω της κοινής χρήσης ηλεκτρονίων. Στην περίπτωση του Ο3, για παράδειγμα, ενός μορίου όζοντος, τα τρία άτομα οξυγόνου που συνθέτουν αυτό το μόριο συνδέονται με μοναδικό τρόπο. Δύο από τα άτομα οξυγόνου συνδέονται με έναν διπλό ομοιοπολικό δεσμό (δύο ζεύγη ηλεκτρονίων μοιράζονται) και ένα από αυτά τα άτομα οξυγόνου μοιράζεται ταυτόχρονα έναν ομοιοπολικό δεσμό συντεταγμένων με ένα τρίτο άτομο οξυγόνου.
Αυτός ο τύπος ταξινόμησης έκανε μια σαφή διάκριση μεταξύ άλλων σωματιδίων που χρησιμοποιούσαν ιονικούς δεσμούς, αλλά σύντομα έγινε αντιληπτό ότι το επίπεδο αλληλεπίδρασης μεταξύ ομοιοπολικών και ιοντικών δεσμών δεν ήταν πλήρως κατανοητό, επομένως η ταξινόμηση των πραγμάτων ως μορίων με βάση τον τύπο δεσμού ήταν άσκοπη. Αυτό οδήγησε σε έναν πολύ ευρύ ορισμό του μορίου που είναι τυπικά αποδεκτός και κατανοητός σήμερα - δύο ή περισσότερα άτομα που συνδέονται μέσω χημικών δεσμών με έναν σταθερό αριθμό ατομικών πυρήνων. Όπως αναφέρθηκε παραπάνω, όλες οι ενώσεις είναι μόρια, αλλά δεν είναι όλα τα μόρια ενώσεις.
Ομοπολικές ενώσεις
Αυτή είναι μια ετικέτα που συνηθίζει να υποδηλώνει συγκεκριμένα πότε ένα μόριο αποτελείται από τουλάχιστον δύο διαφορετικά στοιχεία. Το μεθάνιο, για παράδειγμα, είναι ένα αέριο του θερμοκηπίου που έχει λάβει μεγάλη προσοχή τα τελευταία χρόνια. Το μεθάνιο έχει τον χημικό τύπο CH4 και αποτελείται από ένα άτομο άνθρακα και τέσσερα άτομα υδρογόνου που είναι όλα ομοιοπολικά συνδεδεμένα μεταξύ τους. Κάθε άτομο υδρογόνου μοιράζεται ένα ηλεκτρόνιο με το άτομο άνθρακα. Το μεθάνιο (CH4), το νερό (H2O), ο χλωριούχος άνθρακας (CCl4), η αμμωνία (NH3) και αμέτρητες άλλες ομοιοπολικές ενώσεις θεωρούνται τόσο μόρια όσο και ενώσεις, δεδομένου ότι για να σχηματιστούν βασίζονται μόνο σε μοριακούς δεσμούς.
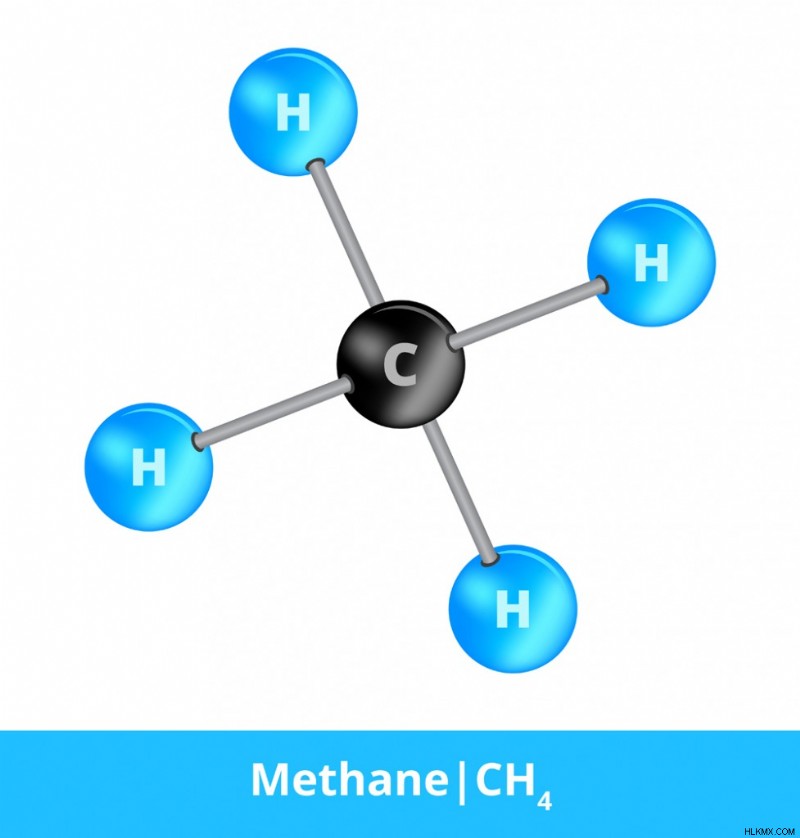
Ομοιοπολικός δεσμός μεθανίου (CH4) (Photo Credit :petrroudny43/Shutterstock)
Ιονικές ενώσεις
Οι ιοντικές ενώσεις είναι παρόμοιες με τους ομοιοπολικούς δεσμούς, αλλά διαφέρουν ως προς το πώς αλληλεπιδρούν τα ηλεκτρόνια των δύο ατόμων. Ιονικές ενώσεις ορίζεται επίσημα ως μια ομάδα ατόμων περισσότερων του ενός στοιχείων που συνδέονται μέσω ιοντικών δεσμών. Σε έναν ομοιοπολικό (μοριακό) δεσμό, τα ηλεκτρόνια μοιράζονται, ενώ σε έναν ιοντικό δεσμό, ένα ή περισσότερα ηλεκτρόνια δίνονται πλήρως σε ένα άλλο άτομο. Αυτό συμβαίνει επειδή σχηματίζεται ένας ιοντικός δεσμός μεταξύ αντίθετα φορτισμένων ιόντων. Με απλά λόγια, ένα ιόν μπορεί να έχει θετικό ή αρνητικό φορτίο, λόγω περίσσειας ή έλλειψης ηλεκτρονίου. Όταν αυτά τα αντίθετα φορτισμένα ιόντα συνδέονται, σχηματίζεται ένας ιοντικός δεσμός. Συνήθως, ένας ιονικός δεσμός είναι ισχυρότερος από έναν ομοιοπολικό δεσμό, λόγω της ισχυρής ελκτικής δύναμης μεταξύ των δύο ιόντων.

Ίσως το πιο κοινό παράδειγμα ιοντικής ένωσης είναι το επιτραπέζιο αλάτι, το NaCl. Ένα ουδέτερο άτομο νατρίου (Na) δεν έχει φορτίο, αλλά αν αυτό το άτομο έχανε ένα ηλεκτρόνιο, θα γινόταν ένα ιόν νατρίου με καθαρό φορτίο +1. Ομοίως, ένα ουδέτερο άτομο χλωρίου δεν έχει φορτίο, αλλά αν αυτό το άτομο αποκτούσε ένα ηλεκτρόνιο, θα είχε καθαρό ιοντικό φορτίο -1. Όταν αυτά τα δύο ιόντα - ένα κατιόν και ένα ανιόν, αντίστοιχα - ενωθούν, το επιπλέον ηλεκτρόνιο από το χλώριο μπορεί να δοθεί στο νάτριο. Αυτό σταθεροποιεί τα δύο άτομα, τα εξωτερικά κελύφη ηλεκτρονίων και των δύο ατόμων γεμίζουν ικανοποιητικά και σχηματίζεται μια ιοντική ένωση, η οποία υπερηφανεύεται για έναν ισχυρό δεσμό που θα είναι πιο δύσκολο να σπάσει από έναν ομοιοπολικό δεσμό.
Μια τελευταία λέξη
Οι λέξεις έχουν μεγάλη δύναμη, επομένως η χρήση των σωστών είναι σημαντική όταν συζητάμε ορισμένους τομείς της επιστήμης. Όσον αφορά τα μόρια και τις ενώσεις, υπάρχουν ορισμένες αποχρώσεις μεταξύ των δύο, αλλά για τους περισσότερους σκοπούς και συζητήσεις, τα δύο μπορούν να χρησιμοποιηθούν εναλλακτικά. Ωστόσο, εάν συζητάτε ένα μόριο που αποτελείται από έναν μόνο τύπο στοιχείου, όπως H2 ή O3, βεβαιωθείτε ότι όχι να το πούμε σύνθετο! Και την επόμενη φορά που θα πασπαλίσετε λίγο αλάτι σε ένα ήπιο γεύμα, προσφέρετε λίγο χάρη στην ιοντική συγκόλληση!