Διαφορά μεταξύ των αντιδράσεων καύσης και οξείδωσης της αιθανόλης
Κύρια διαφορά – Αντιδράσεις καύσης έναντι οξείδωσης αιθανόλης
Η αιθανόλη είναι αλκοόλη με μοριακό τύπο C2 H5 OH. Ο χημικός τύπος της αιθανόλης είναι CH3 CH2 OH. Η αιθανόλη χρησιμοποιείται ως καύσιμο καθώς μπορεί να υποστεί αντιδράσεις καύσης. Μπορεί επίσης να υποστεί αντιδράσεις οξείδωσης για να σχηματίσει μορφές αλδεΰδης και μορφές καρβοξυλικού οξέος. Η κύρια διαφορά μεταξύ των αντιδράσεων καύσης και οξείδωσης της αιθανόλης είναι ότι οι αντιδράσεις καύσης της αιθανόλης παράγουν πάντα θερμότητα και φως, ενώ οι αντιδράσεις οξείδωσης της αιθανόλης δεν παράγουν πάντα θερμότητα και φως.
Βασικές περιοχές που καλύπτονται
1. Ποιες είναι οι αντιδράσεις καύσης της αιθανόλης
– Ορισμός, Ιδιότητες, Αντιδράσεις
2. Ποιες είναι οι Αντιδράσεις Οξείδωσης της Αιθανόλης
– Ορισμός, Ιδιότητες, Αντιδράσεις
3. Ποια είναι η διαφορά μεταξύ των αντιδράσεων καύσης και οξείδωσης της αιθανόλης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αλδεΰδη, βιοκαύσιμα, διοξείδιο του άνθρακα, μονοξείδιο του άνθρακα, καρβοξυλικό οξύ, αντίδραση καύσης, πλήρης καύση, πλήρης οξείδωση, αιθανόλη, βενζίνη, ατελής καύση, ατελής οξείδωση, αντίδραση οξείδωσης 
Ποιες είναι οι Αντιδράσεις Καύσης της Αιθανόλης
Οι αντιδράσεις καύσης της αιθανόλης είναι οι αντιδράσεις που συμβαίνουν κατά την καύση της αιθανόλης. Η αιθανόλη είναι ένα πολύ εύφλεκτο υγρό που μπορεί να χρησιμοποιηθεί ως καύσιμο. Η καύση της αιθανόλης μπορεί να παράγει θερμότητα και φως ως ενέργεια. Επομένως, η καύση της αιθανόλης είναι μια εξώθερμη αντίδραση. Όταν η αιθανόλη καίγεται παρουσία μοριακού οξυγόνου (O2 ), σχηματίζει δύο τελικά προϊόντα. Είναι διοξείδιο του άνθρακα (CO2 ) και μόρια νερού (H2 O).
Η καύση της αιθανόλης υποδεικνύεται από μια μπλε φλόγα. Η καύση της αιθανόλης είναι μια απλή διαδικασία που περιλαμβάνει τον συνδυασμό αιθανόλης και οξυγόνου. Η καύση της αιθανόλης μπορεί να συμβεί με δύο τρόπους.
- Πλήρης καύση
- Ημιτελής καύση

Εικόνα 01:Η μπλε φλόγα υποδηλώνει την πλήρη καύση αιθανόλης.
Η πλήρης καύση έχει ως αποτέλεσμα CO2 και H2 Ο. Αλλά η ατελής καύση θα παράγει μονοξείδιο του άνθρακα (CO) ή άνθρακα (C) ως προϊόν. Η ατελής καύση θα λάβει χώρα όταν δεν υπάρχει επαρκές οξυγόνο (O2 ).
Πλήρης καύση αιθανόλης
CH3 CH2 OH(l) + 3O2(g) → 2CO2(g) + 3H2 O(l)
Ατελής καύση αιθανόλης
CH3 CH2 OH(l) + 2O2(g) → 2CO(g) + 3H2 O(l)
CH3 CH2 OH(l) + O2(g) → C(s) + 3H2 O(l)
Η ατελής καύση οδηγεί συχνά σε μείγμα αερίου μονοξειδίου του άνθρακα (CO) και σκόνης άνθρακα (C).
Η θερμότητα που παράγεται από την καύση αιθανόλης χρησιμοποιείται για την κίνηση του εμβόλου των κινητήρων των οχημάτων. Η αιθανόλη μπορεί επίσης να χρησιμοποιηθεί ως καύσιμο πυραύλων. Επιπλέον, η αιθανόλη μπορεί να παραχθεί ως βιοκαύσιμο από τη βιομάζα φυτικού υλικού. Επομένως, η αιθανόλη παρουσιάζει φιλικές προς το περιβάλλον ιδιότητες από τα ορυκτά καύσιμα.
Η αιθανόλη είναι ένα καλό πρόσθετο για τη βενζίνη. Η ανάμειξη αιθανόλης με βενζίνη αποτρέπει ορισμένες εκπομπές ατμοσφαιρικών ρύπων. Ωστόσο, όταν καίγεται, η αιθανόλη παράγει μια φλόγα που απελευθερώνει ρύπους.
Τι είναι οι αντιδράσεις οξείδωσης της αιθανόλης
Οι αντιδράσεις οξείδωσης της αιθανόλης είναι χημικές αντιδράσεις που λαμβάνουν χώρα όταν η αιθανόλη οξειδώνεται από οξειδωτικά μέσα. Η οξείδωση της αιθανόλης παράγει μια αλδεΰδη που ονομάζεται αιθανάλη ως το πρώτο προϊόν. Μπορεί να υποστεί περαιτέρω οξείδωση για να σχηματίσει τη μορφή καρβοξυλικού οξέος, η οποία είναι γνωστή ως Αιθανοϊκό οξύ.
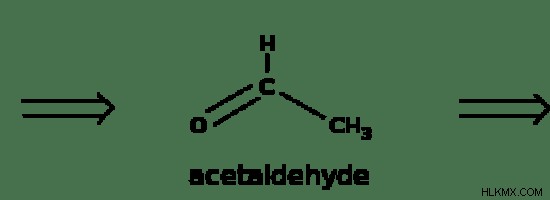
Εικόνα 2:Οξείδωση αιθανόλης
Ωστόσο, η οξείδωση της αιθανόλης μπορεί επίσης να συμβεί παρουσία καταλύτη. Αυτός ο καταλύτης χρησιμοποιείται για τη μείωση της ενέργειας ενεργοποίησης της αντίδρασης οξείδωσης. Εάν η ενέργεια ενεργοποίησης είναι υψηλή, η αντίδραση δεν θα ξεκινήσει. Η οξείδωση μπορεί να συμβεί σε δύο φάσεις:
- Πλήρης οξείδωση
- Ημιτελής οξείδωση
Η πλήρης οξείδωση της αιθανόλης σχηματίζει το αιθανικό οξύ ως τελικό προϊόν. Η ατελής οξείδωση της αιθανόλης σχηματίζει την αιθανάλη ως τελικό προϊόν. Και οι δύο οξειδώσεις θα παράγουν μόρια νερού (H2 O) ως υποπροϊόντα.
Πλήρης οξείδωση της αιθανόλης
Αιθανόλη + Οξυγόνο → Αιθανόλη + Νερό →
CH3 CH2 OH(l) + [O] → CH3 CHO(l) + H2 O(l) → CH3 COOH(l) + H2 O(l)
Η πλήρης οξείδωση της αιθανόλης έχει ως αποτέλεσμα Αιθανοϊκό οξύ στο τέλος της αντίδρασης. Όμως, η οξείδωση με αιθανόλη σχηματίζει πρώτα την αιθανάλη και στη συνέχεια η αιθανάλη οξειδώνεται περαιτέρω σε αιθανοϊκό οξύ.
Ατελής οξείδωση της αιθανόλης
Αιθανόλη + Οξυγόνο → Αιθανόλη + Νερό
CH3 CH2 OH(l) + [O] → CH3 CHO(l) + H2 O(l)
Στην παραπάνω εξίσωση, το [O] δείχνει το ατομικό οξυγόνο που προέρχεται από τον οξειδωτικό παράγοντα. Για παράδειγμα, ας εξετάσουμε το διχρωμικό νάτριο (Na2 Cr2 O7 ) χρησιμοποιήθηκε ως οξειδωτικός παράγοντας μαζί με θειικό οξύ (H2 SO4 ).
CH3 CH2 OH(l) + Να2 Cr2 O7(aq) + H2 SO4(aq) → CH3 CHO(l) + 2NaCrO4(aq) + 2H2 O(l)
Η οξείδωση της αιθανόλης χρειάζεται είτε καταλύτη είτε οξειδωτικό παράγοντα προκειμένου να ολοκληρωθεί η αντίδραση. Ωστόσο, η οξείδωση της αιθανόλης δεν παράγει θερμότητα ή φως ως μορφές ενέργειας. Ένας άλλος τρόπος οξείδωσης της αιθανόλης είναι μέσω καταλυτών. Ο καταλύτης αργύρου είναι ένας τέτοιος καταλύτης. Η αιθανόλη μπορεί να οξειδωθεί περνώντας ένα μείγμα ατμού αιθανόλης και αέρα πάνω από έναν καταλύτη αργύρου στους 500C. Αυτό έχει ως αποτέλεσμα την αιθανάλη ως προϊόν μαζί με το νερό (H2 O).
Διαφορά μεταξύ των αντιδράσεων καύσης και οξείδωσης της αιθανόλης
Ορισμός
Αντιδράσεις καύσης αιθανόλης: Οι αντιδράσεις καύσης της αιθανόλης είναι οι αντιδράσεις που συμβαίνουν όταν καίγεται η αιθανόλη.
Αντιδράσεις οξείδωσης της αιθανόλης: Οι αντιδράσεις οξείδωσης της αιθανόλης είναι χημικές αντιδράσεις που λαμβάνουν χώρα όταν η αιθανόλη οξειδώνεται από οξειδωτικά μέσα.
Οξειδωτικοί παράγοντες
Αντιδράσεις καύσης αιθανόλης: Οι αντιδράσεις καύσης αιθανόλης δεν απαιτούν οξειδωτικά μέσα.
Αντιδράσεις οξείδωσης της αιθανόλης: Οι αντιδράσεις οξείδωσης της αιθανόλης απαιτούν την παρουσία οξειδωτικών παραγόντων.
Καταλύτες
Αντιδράσεις καύσης αιθανόλης: Οι αντιδράσεις καύσης της αιθανόλης δεν χρειάζονται καταλύτες.
Αντιδράσεις οξείδωσης της αιθανόλης: Αντιδράσεις οξείδωσης της αιθανόλης μπορεί να συμβούν παρουσία καταλυτών.
Τελικά προϊόντα
Αντιδράσεις καύσης αιθανόλης: Τα τελικά προϊόντα των αντιδράσεων οξείδωσης της αιθανόλης μπορεί να είναι CO2 , CO, C και H2 O.
Αντιδράσεις οξείδωσης της αιθανόλης: Τα τελικά προϊόντα των αντιδράσεων καύσης της αιθανόλης μπορεί να είναι είτε αιθανάλη είτε αιθανοϊκό οξύ μαζί με H2 O.
Μορφές ενέργειας
Αντιδράσεις καύσης αιθανόλης: Οι αντιδράσεις καύσης της αιθανόλης μπορούν να παράγουν θερμότητα και φως.
Αντιδράσεις οξείδωσης της αιθανόλης: Οι αντιδράσεις οξείδωσης της αιθανόλης δεν μπορούν να παράγουν θερμότητα και φως.
Συμπέρασμα
Η καύση είναι επίσης μια αντίδραση οξείδωσης αφού το τελικό προϊόν της καύσης είναι πάντα ένα οξειδωμένο είδος. Επιπλέον, η καύση περιλαμβάνει τον συνδυασμό οξυγόνου με το αρχικό υλικό. Αυτό δείχνει επίσης ότι η καύση είναι μια αντίδραση οξείδωσης. Αν και υπάρχουν ομοιότητες μεταξύ αυτών των δύο φαινομένων, υπάρχουν διακριτές ιδιότητες που μας επιτρέπουν να διακρίνουμε τη διαφορά μεταξύ των αντιδράσεων καύσης και οξείδωσης της αιθανόλης.




