Τι είναι το ισότοπο;
Τα ισότοπα είναι διαφορετικές μορφές του ίδιου στοιχείου . Τα ισότοπα ενός στοιχείου έχουν ίσο αριθμό πρωτονίων και ηλεκτρόνια αλλά διαφορετικό αριθμό νετρονίων .
Αυτό σημαίνει ότι έχουν τον ίδιο ατομικό αριθμό (αριθμός πρωτονίων) αλλά διαφορετικό μαζικό αριθμό (αριθμός πρωτονίων και νετρονίων).
Μοντέλα ισοτόπων χάρτινης πλάκας
Αυτά τα πολύ απλά μοντέλα χάρτινης πλάκας δείχνουν τη διαφορά μεταξύ Carbon-13 και Carbon -12. Υπάρχει επίσης ένας άνθρακας-14 που είναι ραδιενεργός καθώς τα επιπλέον 2 νετρόνια τον καθιστούν ασταθή.

Θυμηθείτε – τα στοιχεία έχουν πάντα τον ίδιο ατομικό αριθμό ( αριθμός πρωτονίων ) αλλά ο μαζικός αριθμός ( αριθμός πρωτονίων και νετρονίων ) μπορεί να είναι διαφορετικός.

Παραδείγματα ισοτόπων
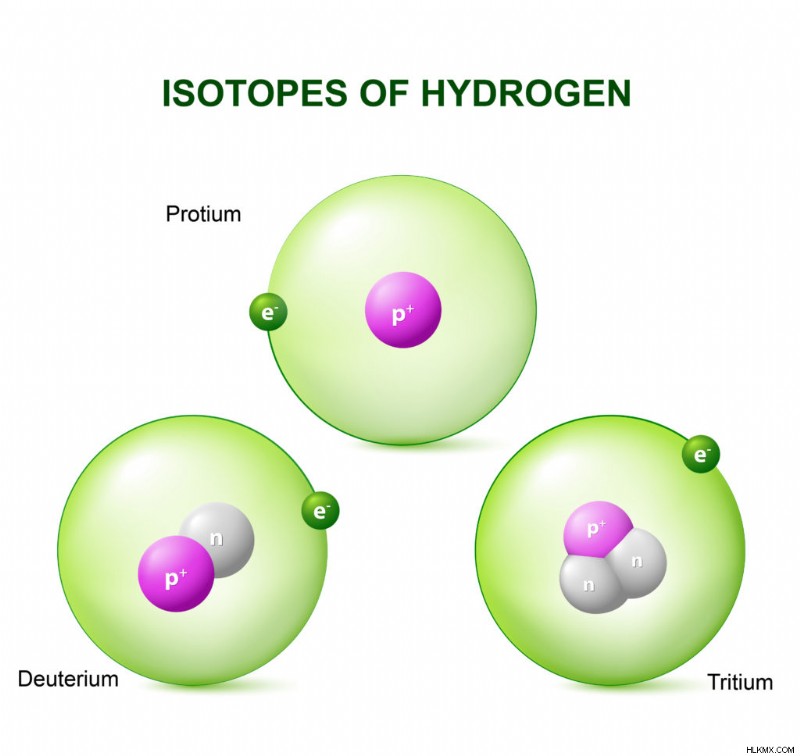
Ισότοπα του υδρογόνου
Υδρογόνο -1
Hydrogen-2
Hydrogen-3
Η πιο κοινή μορφή υδρογόνου είναι το Protium. Το Protium δεν έχει νετρόνια.
Το δευτέριο έχει 1 νετρόνιο και το τρίτιο έχει 2 νετρόνια.
Το τρίτιο είναι ραδιενεργό.
Στοιχεία για τα ισότοπα
Κασσίτερος έχει τα πιο σταθερά ισότοπα από οποιοδήποτε στοιχείο.
Η μάζα ενός ισοτόπου είναι ο αριθμός των πρωτονίων συν τον αριθμό των νετρονίων.
Το υδρογόνο είναι το μόνο στοιχείο του οποίου τα ισότοπα έχουν τα δικά τους ονόματα!
Το καίσιο και το ξένο έχουν τα πιο φυσικά ισότοπα με 36 το καθένα!
Τα ασταθή ισότοπα είναι ραδιενεργά.





