Αρχή Aufbau
Τι είναι η Αρχή Aufbau;
Η αρχή Aufbau δηλώνει ότι τα ηλεκτρόνια θα γεμίσουν πρώτα τα κελύφη ηλεκτρονίων χαμηλότερης ενέργειας σε ένα ουδέτερο άτομο. Τα ηλεκτρόνια γεμίζουν τροχιακά από τροχιακά χαμηλότερης ενέργειας έως τροχιακά υψηλότερης ενέργειας. Η αρχή Aufbau βοηθά στον προσδιορισμό της ηλεκτρονικής δομής ενός ατόμου.
Τα κελύφη της γενικής σειράς που συμπληρώνονται είναι 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s. Αυτή η παραγγελία παρουσιάζεται επίσης οπτικά παρακάτω.
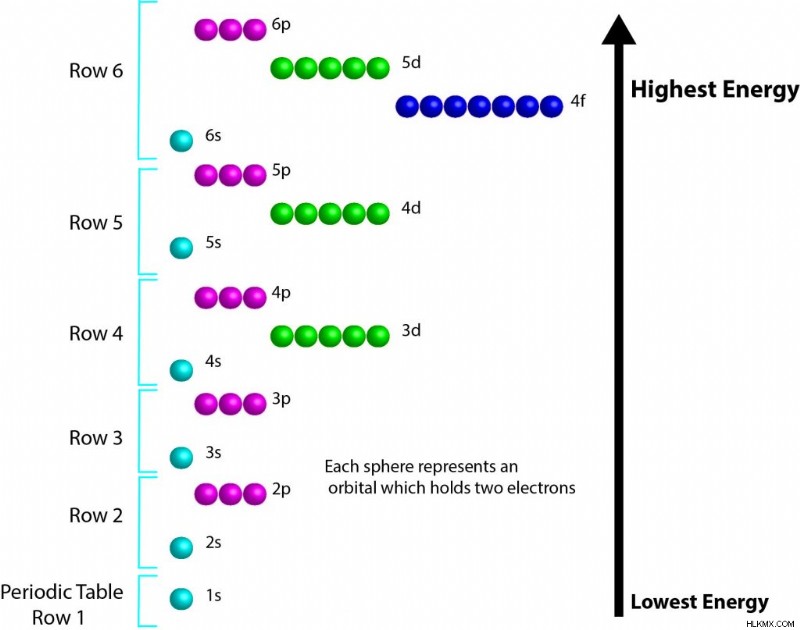
Μπορεί να είναι χρήσιμο να παρατηρήσετε μερικά μοτίβα όταν προσπαθείτε να θυμηθείτε τη σειρά για τα τροχιακά d και f. Το p- και το s- τροχιακό έχουν πάντα τον ίδιο βασικό αριθμό ενεργειακής στάθμης με τη σειρά στην οποία βρίσκονται. Όταν το μπλοκ d μπαίνει στο παιχνίδι, ο βασικός αριθμός ενεργειακής του στάθμης θα είναι πάντα ένα μικρότερος από τον αριθμό της σειράς ή την τιμή του s- μπλοκ έρχεται μετά. Για το μπλοκ f, ο βασικός αριθμός στάθμης ενέργειας θα είναι πάντα δύο μικρότερος από την τρέχουσα σειρά. Ένα χρήσιμο διάγραμμα αυτής της έννοιας βρίσκεται σε αυτήν τη σελίδα για την ηλεκτρονική δομή. Ένας διαφορετικός τρόπος για να απεικονίσετε τις σχετικές ενέργειες μπορείτε να βρείτε εδώ.
Το κέλυφος s μπορεί να χωρέσει δύο ηλεκτρόνια. Το επίπεδο p μπορεί να χωρέσει 6 ηλεκτρόνια. Το επίπεδο d μπορεί να χωρέσει 10 ηλεκτρόνια. Και τέλος, το τροχιακό f χωράει έως και 14 ηλεκτρόνια.
Κατά την πλήρωση τροχιακών, πρέπει επίσης να τηρούνται η Αρχή Αποκλεισμού Pauli και ο Κανόνας του Hund.
Η λέξη Aufbau προέρχεται από τη γερμανική λέξη building up ή κατασκευή . Τα ηλεκτρόνια σε ένα άτομο πρέπει να δημιουργηθούν από το χαμηλότερο επίπεδο ενέργειας έως το υψηλότερο επίπεδο ενέργειας.
Ο κανόνας του Madelung
Ένας άλλος τρόπος για να προσδιορίσετε ποιο τροχιακό θα γεμίσει στη συνέχεια είναι η χρήση της τιμής του n + l . n είναι το βασικό επίπεδο ενέργειας ή ο κύριος κβαντικός αριθμός. l είναι ο τροχιακός τύπος ή ο αζιμουθιακός κβαντικός αριθμός – s=0, p=1, d=2 και f=3. Όποιο τροχιακό έχει το χαμηλότερο n +l η τιμή θα συμπληρωθεί πρώτα. Εάν δύο τροχιακά έχουν την ίδια τιμή, αυτό με τη χαμηλότερη τιμή n θα γεμίσει πρώτο.
Εξαιρέσεις από τον κανόνα Aufbau
Υπάρχουν μερικές εξαιρέσεις στην αρχή Aufbau. Αυτά προέρχονται κυρίως από άτομα στα μπλοκ d- (μετάλλα μετάπτωσης) και f- (λανθανίδες και ακτινίδες) του περιοδικού πίνακα. Οι εξαιρέσεις επίσης συνήθως προέρχονται από στοιχεία με ατομικό αριθμό μεγαλύτερο από 40. Αυτές οι εξαιρέσεις συμβαίνουν επειδή υπάρχει αυξημένη σταθερότητα από τα μισά και πλήρως γεμάτα τροχιακά, γεγονός που μειώνει τη συνολική ενέργεια του ατόμου. Σε αυτές τις περιπτώσεις, η σταθερότητα αυξάνεται επειδή τα ηλεκτρόνια μπορεί να είναι πιο μακριά το ένα από το άλλο. Επιπλέον, η διαφορά ενέργειας μεταξύ των τροχιακών είναι μικρότερη σε υψηλότερους ατομικούς αριθμούς.
Μερικά από τα στοιχεία με εξαιρέσεις:
- Το χρώμιο (Cr) θα είναι [Ar]3d4s αντί του αναμενόμενου [Ar]3d4s. Αυτό οφείλεται στο γεγονός ότι υπάρχει αυξημένη σταθερότητα από τα μισογεμάτα τροχιακά έναντι των μερικώς γεμάτα τροχιακά.
- Ο χαλκός, το ασήμι και ο χρυσός (όλα στη στήλη 11) έχουν όλα ένα ηλεκτρόνιο που αναμένεται να βρίσκεται στο τροχιακό s που πηγαίνει στο τροχιακό d
- Αυτές είναι μερικές από τις εξαιρέσεις, μερικά από τα άλλα στοιχεία που έχουν εξαιρέσεις είναι το παλλάδιο, το μολυβδαίνιο, το ρόδιο και η πλατίνα.
Επιπλέον, τα ηλεκτρόνια δεν αφήνουν πάντα τα άτομα από το υψηλότερο ενεργειακό κέλυφος με βάση τον κανόνα Aufbau. Όταν ένα ηλεκτρόνιο φεύγει, το άτομο γίνεται ιόν και ο κανόνας Aufbau δεν ισχύει πλέον.
Παράδειγμα Διαμορφώσεις ηλεκτρονίων Χρήση της Αρχής Aufbau
Διαμόρφωση ηλεκτρονίων άνθρακα
Ο ατομικός αριθμός του άνθρακα είναι 6. Επομένως ο άνθρακας έχει έξι ηλεκτρόνια. Σύμφωνα με την αρχή Aufbau, ξεκινάμε το γέμισμα από το φλοιό χαμηλότερης ενέργειας, το 1s, το οποίο περιέχει 2 ηλεκτρόνια. Τώρα απομένουν 4 ηλεκτρόνια. Δύο ηλεκτρόνια μπαίνουν στη συνέχεια στο τροχιακό 2s. Και τα υπόλοιπα δύο ηλεκτρόνια πηγαίνουν στο τροχιακό 2p. Αν διαγραφεί, η διαμόρφωση ηλεκτρονίων είναι 1s2s2p.
Διαμόρφωση ηλεκτρονίων ασβεστίου
Ο ατομικός αριθμός του ασβεστίου είναι 20. Επομένως, το ασβέστιο έχει είκοσι ηλεκτρόνια. Αντί να μετράμε από κέλυφος προς το είκοσι, μπορούμε να απλοποιήσουμε. Γνωρίζουμε ότι το πρώτο κέλυφος περιέχει 2 ηλεκτρόνια. Και το επόμενο κέλυφος περιέχει 8 ηλεκτρόνια. Αυτό μας αφήνει 10 ηλεκτρόνια. Αυτό είναι παρόμοιο με τη χρήση της συντομογραφίας μεθόδου διαμόρφωσης ηλεκτρονίων. Μέχρι στιγμής έχουμε γράψει τη διαμόρφωση ευγενούς αερίου του νέον (LINK). Ωστόσο, το ασβέστιο βρίσκεται στην τέταρτη σειρά, επομένως μπορούμε επίσης να μεταβούμε στη διαμόρφωση του ευγενούς αερίου του αργού. Μετά από αυτό έχουμε 2 ηλεκτρόνια. Το επόμενο χαμηλότερο ενεργειακό κέλυφος είναι το 4s.
Η ηλεκτρονική διαμόρφωση του ασβεστίου τότε είναι 1s2s2p3s3p4s ή [Ar]4s.
Διαμόρφωση ηλεκτρονίων βρωμίου
Το βρώμιο βρίσκεται στην τέταρτη σειρά του περιοδικού πίνακα και έχει ατομικό αριθμό 35. Χρησιμοποιώντας το διάγραμμα από πάνω μπορούμε να μετρήσουμε έως και 35 ηλεκτρόνια. Η σειρά 1 μας δίνει δύο ηλεκτρόνια. Η σειρά 2 παρέχει οκτώ ηλεκτρόνια, όπως και η τρίτη σειρά. Αυτό είναι συνολικά 18 ηλεκτρόνια και η ηλεκτρονική διαμόρφωση του αργού (Ar). Στη συνέχεια, διασχίζουμε τη σειρά 4. Πρώτα τα 4s, μετά παίρνουμε το μπλοκ d που θα έχει τον βασικό αριθμό ενέργειας 3. Η μέτρηση μέχρι το βρώμιο μας δείχνει ότι υπάρχουν 5 ηλεκτρόνια στο μπλοκ p.
Επομένως, η διαμόρφωση ηλεκτρονίων είναι 1s2s2p3s3p4s 3d4p ή [Ar]4s 3d4p.
Σχετικά σεμινάρια
- Εγγραφή διαμορφώσεων κελύφους ηλεκτρονίων
- Κανόνας του Χουντ
- Κατανόηση του Περιοδικού Πίνακα
- Κβαντικοί αριθμοί και τροχιακά σχήματα
- Τροχιακά ηλεκτρονίων




