Διαφορά μεταξύ ισοτόπων και ισοβαρών
Κύρια διαφορά – Ισότοπα εναντίον ισοβαρών
Ένα άτομο ενός χημικού στοιχείου αποτελείται πάντα από έναν πυρήνα που περιβάλλεται από ένα νέφος ηλεκτρονίων. Ο πυρήνας αποτελείται από πρωτόνια και νετρόνια. Ο αριθμός των πρωτονίων που υπάρχουν σε ένα άτομο ενός συγκεκριμένου στοιχείου είναι πάντα ο ίδιος. Αυτό σημαίνει ότι ο αριθμός των πρωτονίων είναι μια μοναδική ιδιότητα ενός χημικού στοιχείου. Ωστόσο, ο αριθμός των νετρονίων που υπάρχουν στον πυρήνα μπορεί να ποικίλλει σε άτομα του ίδιου στοιχείου. Αυτές οι διαφορετικές μορφές ονομάζονται ισότοπα. Η ατομική μάζα ενός συγκεκριμένου στοιχείου είναι το άθροισμα των πρωτονίων και των νετρονίων στον πυρήνα αυτού του στοιχείου. Μερικές φορές, οι ατομικές μάζες διαφορετικών στοιχείων μπορεί να είναι ίδιες αν και οι ατομικοί τους αριθμοί είναι διαφορετικοί μεταξύ τους. Αυτές οι διαφορετικές μορφές ονομάζονται ισοβαρείς. Η κύρια διαφορά μεταξύ ισοτόπων και ισοβαρών είναι ότι οι ατομικές μάζες των ισοτόπων είναι διαφορετικές μεταξύ τους ενώ οι ατομικές μάζες των ισοβαρών είναι παρόμοιες μεταξύ τους.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα Ισότοπα
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι τα Ισοβάρα
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ ισοτόπων και ισοβαρών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ατομική μάζα, Ατομικός αριθμός, Ισόβαροι, Ισότοπα, Νουκλόνιο, Νετρόνιο, Πρωτόνιο 
Τι είναι τα ισότοπα
Τα ισότοπα είναι διαφορετικές ατομικές δομές του ίδιου στοιχείου. Αυτό σημαίνει ότι τα ισότοπα έχουν τον ίδιο ατομικό αριθμό αλλά διαφορετικές ατομικές μάζες. Αυτό συμβαίνει επειδή ο ατομικός αριθμός είναι μια μοναδική ιδιότητα για ένα χημικό στοιχείο λόγω της παρουσίας του ίδιου αριθμού πρωτονίων στον πυρήνα. Ωστόσο, οι ατομικές μάζες των ισοτόπων μπορεί να διαφέρουν μεταξύ τους, καθώς η ατομική μάζα εξαρτάται από τον αριθμό των νετρονίων που υπάρχουν στον πυρήνα και τα ισότοπα έχουν διαφορετικούς αριθμούς νετρονίων.
Τα ισότοπα παρουσιάζουν ομοιότητες στις χημικές τους ιδιότητες, καθώς οι χημικές ιδιότητες ενός στοιχείου εξαρτώνται κυρίως από τα ηλεκτρόνια που υπάρχουν στα άτομα. Τα ισότοπα ενός στοιχείου έχουν τον ίδιο αριθμό ηλεκτρονίων και την ίδια διάταξη ηλεκτρονίων.
Οι φυσικές ιδιότητες των ισοτόπων ενδέχεται να διαφέρουν μεταξύ τους. Γενικά, οι φυσικές ιδιότητες εξαρτώνται από την ατομική μάζα και τα ισότοπα έχουν διαφορετικές ατομικές μάζες. Μερικά παραδείγματα ισοτόπων περιλαμβάνουν τα ισότοπα υδρογόνου, ηλίου, άνθρακα, λιθίου κ.λπ.
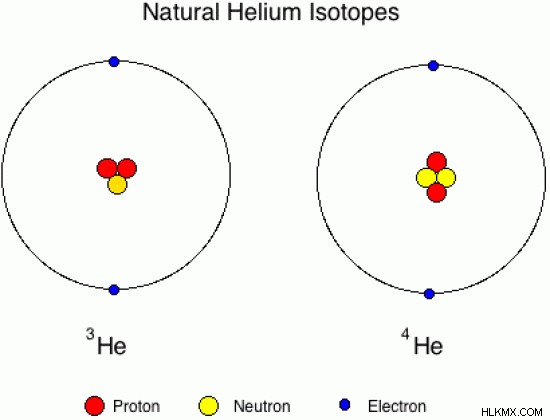
Εικόνα 01:Φυσικά ισότοπα ηλίου
Η παραπάνω εικόνα δείχνει τις ατομικές δομές των φυσικών ισοτόπων του ηλίου. Εδώ, ένα ισότοπο ηλίου αποτελείται από 1 νετρόνια, ενώ το άλλο αποτελείται από 2 νετρόνια. Αλλά και οι δύο έχουν τον ίδιο ατομικό αριθμό, 2. Οι ατομικές μάζες είναι διαφορετικές.
Τι είναι οι ισοβαρείς
Οι ισοβαρείς είναι χημικά στοιχεία που έχουν την ίδια ατομική μάζα. Η ατομική μάζα ενός χημικού στοιχείου δίνεται από το άθροισμα του αριθμού των πρωτονίων και των νετρονίων. Ένα πρωτόνιο ή ένα νετρόνιο από μόνο του ονομάζεται νουκλεόνιο . Επομένως, ο αριθμός των νουκλεονίων ισούται με την ατομική μάζα. Ως εκ τούτου, οι ισοβαρείς έχουν τον ίδιο αριθμό νουκλεονίων. Ωστόσο, μόνο οι αριθμοί των πρωτονίων και των νετρονίων είναι πάντα διαφορετικοί μεταξύ τους σε ισοβαρείς.
Οι ισοβαρείς αποτελούνται από τον ίδιο αριθμό ηλεκτρονίων. Αυτό δείχνει ότι οι ισοβαρείς έχουν τις ίδιες χημικές ιδιότητες. Οι φυσικές ιδιότητες είναι επίσης ίδιες επειδή οι ατομικές μάζες είναι ίδιες. Δεδομένου ότι οι ατομικοί αριθμοί είναι διαφορετικοί, οι ισοβαρείς είναι διαφορετικά χημικά στοιχεία.
Π.χ.: Σειρά ισοβαρών με ατομική μάζα 64.
- Κοβάλτιο (Co)
- Νίκελο (Ni)
- Χαλκός (Cu)
- Σίδηρος (Fe)
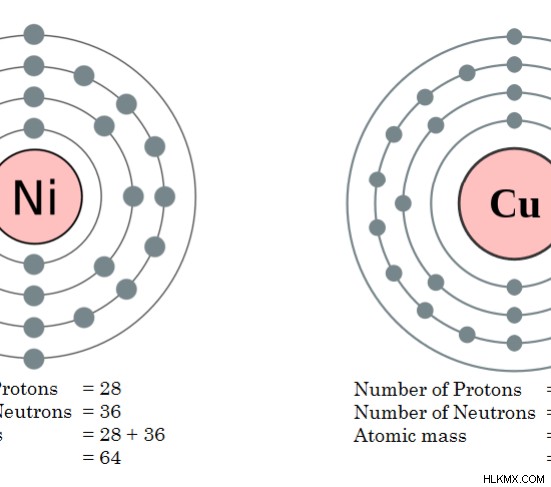
Εικόνα 2:Ατομικές μάζες χαλκού και νικελίου
Ισόβαρες με ατομική μάζα 3.
- Υδρογόνο (H)
- Ήλιο (Αυτός)
Διαφορά μεταξύ ισοτόπων και ισοβαρών
Ορισμός
Ισότοπα: Τα ισότοπα είναι διαφορετικές ατομικές δομές του ίδιου στοιχείου.
Isobars: Οι ισοβαρείς είναι χημικά στοιχεία που έχουν την ίδια ατομική μάζα.
Ατομικός αριθμός
Ισότοπα: Οι ατομικοί αριθμοί των ισοτόπων είναι ίσοι μεταξύ τους.
Isobars: Οι ατομικοί αριθμοί των ισοβαρών είναι διαφορετικοί μεταξύ τους.
Ατομική μάζα
Ισότοπα: Οι ατομικές μάζες των ισοτόπων είναι διαφορετικές μεταξύ τους.
Isobars: Οι ατομικές μάζες των ισοβαρών είναι ίσες μεταξύ τους.
Χημικό στοιχείο
Ισότοπα: Τα ισότοπα είναι το ίδιο χημικό στοιχείο σε διαφορετικές μορφές.
Isobars: Οι ισοβαρείς είναι διαφορετικά χημικά στοιχεία.
Φυσικές ιδιότητες
Ισότοπα: Οι φυσικές ιδιότητες είναι διαφορετικές μεταξύ τους στα ισότοπα.
Isobars: Οι περισσότερες από τις φυσικές ιδιότητες είναι παρόμοιες στις ισοβαρείς.
Συμπέρασμα
Τα ισότοπα και οι ισοβαρείς είναι παραδείγματα για τις σχέσεις μεταξύ χημικών στοιχείων. Τα ισότοπα αναφέρονται σε διαφορετικές μορφές των ίδιων χημικών στοιχείων. Οι ισοβαρείς αναφέρονται στη σχέση μεταξύ ορισμένων διαφορετικών χημικών στοιχείων που μοιράζονται την ίδια ιδιότητα. Επομένως, είναι πολύ σημαντικό να κατανοήσουμε τη διαφορά μεταξύ ισοτόπων και ισοβαρών.
Αναφορές:
1. «Τι είναι το Isobar;» Study.com. Study.com, ν.δ. Ιστός. Διαθέσιμο εδώ. 20 Ιουλίου 2017.
2. Helmenstine, Ph.D. Άννα Μαρί. «Τι είναι ένα ισότοπο; Ορισμός και παραδείγματα." ThoughtCo. Ν.π., ν.δ. Ιστός. Διαθέσιμο εδώ. 20 Ιουλίου 2017.
Εικόνα Ευγενική προσφορά:
1." Helium-3 and Helium-4″ Από Uwe W. – Δική δουλειά (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. "Electron shell 029 Copper" (CC BY-SA 2.0 uk) μέσω Commons Wikimedia
3. "Electron shell 028 nickel" (CC BY-SA 2.0 uk) μέσω Commons Wikimedia




