Πεντοξείδιο του φωσφόρου P2O5
Το πεντοξείδιο του φωσφόρου έχει τον τύπο P4O10 και είναι ένα λευκό κρυσταλλικό στερεό. Ο ανυδρίτης του φωσφορικού οξέος, αυτή η ανόργανη χημική ένωση είναι επίσης γνωστή ως φωσφορικός ανυδρίτης, οξείδιο του φωσφόρου (V), πεντοξείδιο του διφωσφόρου, δεκαοξείδιο του τετραφωσφόρου και δεκοξείδιο του τετραφωσφόρου. Επειδή η ένωση είναι εξαιρετικά υγροσκοπική, χρησιμοποιείται ως ισχυρό ξηραντικό και αφυδατωτή.
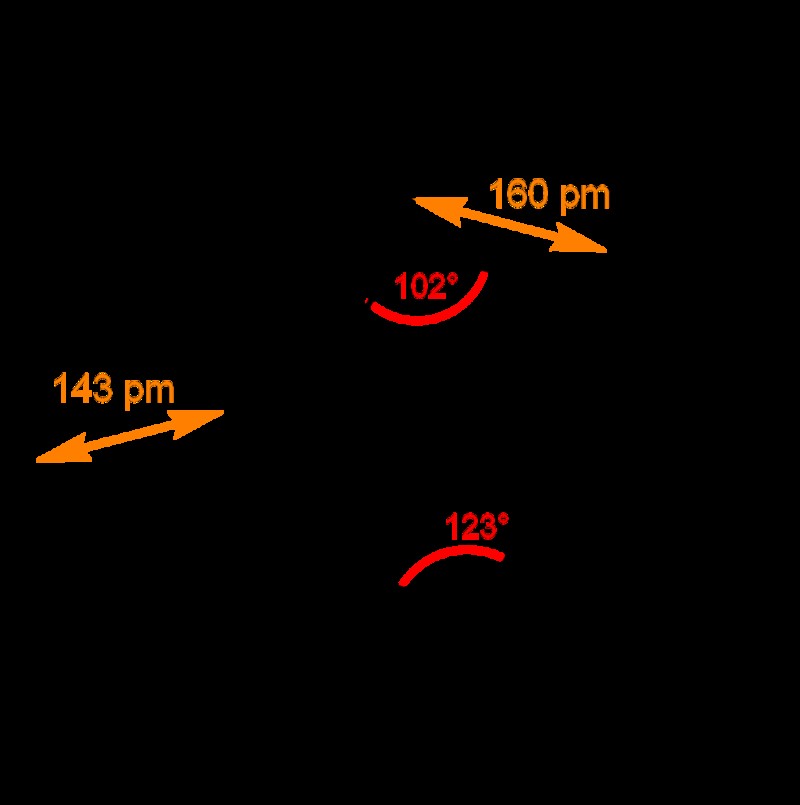
Δομή πεντοξειδίου του φωσφόρου:
Υπάρχουν τουλάχιστον τέσσερα πολύμορφα πεντοξειδίου του φωσφόρου όταν κρυσταλλώνεται. Η πιο γνωστή, μια μετασταθερή μορφή, αποτελείται από μόρια P4O10. Αυτά τα μόρια συγκρατούνται μαζί σε ένα εξαγωνικό πλέγμα από ασθενείς δυνάμεις van der Waals (Ωστόσο, παρά την υψηλή συμμετρία των μορίων, η κρυσταλλική συσκευασία δεν είναι στενή συσκευασία). Η δομή του κλωβού P4O10 είναι παρόμοια με το αδαμαντάνιο με ομάδα σημείων συμμετρίας Td. Σχετίζεται στενά με το P4O6, τον ομώνυμο ανυδρίτη φωσφορικού οξέος. Δεν υπάρχουν τερματικές οξο ομάδες στις τελευταίες. Ζυγίζει 2,30 g/cm3 και έχει πυκνότητα 2,30 g/cm3. Βράζει στους 423°C σε ατμοσφαιρική πίεση και μπορεί να εξαχνωθεί αν θερμανθεί αρκετά γρήγορα. Αυτή η μορφή δημιουργείται από την ταχεία συμπύκνωση ατμών πεντοξειδίου του φωσφόρου, παράγοντας ένα πολύ υγροσκοπικό στερεό.
Τα άλλα πολύμορφα είναι πολυμερή, αλλά το καθένα περιέχει ένα τετράεδρο ατόμων οξυγόνου, ένα από τα οποία σχηματίζει ένα τερματικό Σύνδεση P=O με δωρεά των τερματικών ηλεκτρονίων ρ-τροχιακού οξυγόνου στους μονούς δεσμούς φωσφόρου-οξυγόνου με αντιδέσμευση. Η μακρομοριακή μορφή μπορεί να δημιουργηθεί με θέρμανση της ένωσης για αρκετές ώρες σε σφραγισμένο σωλήνα και διατήρηση του τήγματος σε υψηλή θερμοκρασία πριν από την ψύξη του τήγματος σε στερεό. Η μετασταθερή ορθορομβική μορφή «Ο» (πυκνότητα 2,72 g/cm3, σημείο τήξης 562 °C) έχει πολυστρωματική δομή παρόμοια με αυτή ορισμένων πολυπυριτικών, με διασυνδεδεμένους δακτυλίους P6O6. Η σταθερή μορφή είναι μια υψηλότερης πυκνότητας ορθορομβική φάση γνωστή ως O «μορφή. Αποτελείται από ένα τρισδιάστατο πλαίσιο με πυκνότητα 3,5 g/cm3. Το τελευταίο πολύμορφο είναι μια υαλώδης ή άμορφη ουσία που μπορεί να δημιουργηθεί με τη σύντηξη οποιασδήποτε από τις άλλες.
Προετοιμασία:
Όταν ο τετραφωσφόρος p4 καίγεται παρουσία αρκετού οξυγόνου, παράγεται πεντοξείδιο του φωσφόρου. Ακολουθεί η χημική αντίδραση:
P4 + 5O2 =P4O10
Αυτό το υλικό είναι καθαρή πηγή φωσφορικού οξέος.
Δομή Lewis:
Υπάρχουν δύο στοιχεία στη δομή Lewis του P2O5:ο φώσφορος και το οξυγόνο. Στη δομή Lewis του πεντοξειδίου του φωσφόρου, δύο άτομα φωσφόρου συνδέονται με ένα άτομο οξυγόνου (P2O5). Κάθε άλλο άτομο οξυγόνου έχει σχηματίσει διπλό δεσμό με ένα άτομο φωσφόρου.
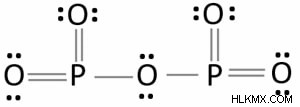
Το κεντρικό άτομο οξυγόνου έχει σχηματίσει απλούς δεσμούς με δύο άτομα φωσφόρου σε αυτή τη δομή Lewis. Τρία άτομα οξυγόνου έχουν σχηματίσει συνδέσεις με κάθε άτομο φωσφόρου. Αυτό το μόριο περιέχει τέσσερις (P=O) διπλούς δεσμούς. Στη δομή Lewis του P2O5, δεν υπάρχουν φορτία στα άτομα.
Φυσικές ιδιότητες
Το πεντοξείδιο του φωσφόρου είναι μια λευκή σκόνη χωρίς οσμή.
Είναι πολύ νόστιμο και απορροφά εύκολα την υγρασία.
P4O10 είναι ο χημικός τύπος. Παρόλα αυτά, ονομάστηκε από τον εμπειρικό τύπο του, P2O5.
Είναι μη εύφλεκτο, αλλά όταν εκτίθεται στη θερμότητα, αποσυντίθεται εκρηκτικά.
Το πεντοξείδιο του φωσφόρου έχει μοριακή μάζα 283,9 g/mol.
2,39 g/cm3 είναι η πυκνότητα.
Το σημείο τήξης αυτού του P2O5 είναι 613K.
Έχει σημείο βρασμού 633 βαθμούς Φαρενάιτ.
Χημικές ιδιότητες:
Είναι μια όξινη χημική ουσία που σχηματίζει φωσφορικό οξύ όταν ενώνεται με το νερό.
Μπορεί να βρεθεί σε τέσσερα διαφορετικά πολύμορφα ή μορφές όταν κρυσταλλωθεί.
Η υδρόλυση, μια διαδικασία μεταξύ πεντοξειδίου του φωσφόρου και νερού, παράγει μεγάλη ποσότητα θερμότητας. Είναι μια εξώθερμη διαδικασία.
P4O10 + 6H2O → 4H3PO4 (–177 kJ )
Το μετατρέπει σε νιτρίλιο όταν αντιδρά με αμίδια.
P4O10 + RC(O)NH2 → P4O9(OH)2 + RCN
Επειδή το πεντοξείδιο του φωσφόρου είναι εξαιρετικά διαβρωτικό, θα πρέπει να διατηρείται μακριά από μέταλλα.
Εφαρμογή:
Χρησιμοποιείται ως αφυδατωτικός παράγοντας λόγω της ικανότητάς του να απορροφά την υγρασία. Η εξωθερμικότητα είναι υψηλή σε αυτή τη διαδικασία.
P4O10 + 6 H2O → 4H3PO4 (–177 kJ).
Το P4O10 σε κοκκώδη μορφή χρησιμοποιείται σε ξηραντήρες.
Χρησιμοποιείται επίσης για την παρασκευή νιτριλίων από πρωτογενή αμίδια σε διάφορες διαδικασίες χημικής σύνθεσης.
P4O10 + RC(O)NH2 → P4O9(OH)2 + RCN
Χρησιμοποιείται στην παρασκευή ενώσεων φωσφόρου.
Για την οξείδωση της αλκοόλης, χρησιμοποιείται το «αντιδραστήριο Onodera», ένα διάλυμα P4O10.
Χρησιμοποιείται στην παραγωγή οπτικού και θερμομονωτικού γυαλιού.
Η χρήση του ως ξηραντικού παράγοντα ωφελεί ένα ευρύ φάσμα ουσιών, ιδιαίτερα εκείνων με τις οποίες δεν αντιδρά.
Τα φάρμακα το περιέχουν.
Χρησιμοποιείται ως φυτικό λίπασμα στη γεωργική βιομηχανία.
Γιατί το πεντοξείδιο του φωσφόρου ονομάζεται P4O10;
Το P4O10 είναι γνωστό ως πεντοξείδιο του φωσφόρου για Όταν πρόκειται για πεντοξείδιο του φωσφόρου, τα μόρια που έχουν τον τύπο P2O5 θα συνδεθούν μεταξύ τους για να δημιουργήσουν μεγαλύτερα μόρια P4O10. Έτσι, παρά το γεγονός ότι το πεντοξείδιο του φωσφόρου έχει τον χημικό τύπο P4O10, εντούτοις αναφέρεται ως πεντοξείδιο του φωσφόρου λόγω του εμπειρικού του τύπου P2O5.
Συμπέρασμα:
Έχει υψηλή υδατοδιαλυτότητα και εξώθερμη αντίδραση. Η ακετόνη, το οξικό οξύ, το βενζόλιο και το χλωροφόρμιο είναι όλα αδιάλυτα στην ένωση. Η εκρηκτική διάσπαση και η εξώθερμη υδρόλυση είναι δύο σημαντικά χαρακτηριστικά. Χρησιμοποιείται ως επί το πλείστον ως παράγοντας αφυδάτωσης και αποξήρανσης. Το πεντοξείδιο του φωσφόρου δεν είναι εύφλεκτο από μόνο του. Λόγω της εξαιρετικά εξώθερμης φύσης τέτοιων αλληλεπιδράσεων, αντιδρά γρήγορα με νερό και αντικείμενα που περιέχουν νερό όπως ξύλο ή βαμβάκι, απελευθερώνοντας πολλή θερμότητα και ίσως προκαλώντας φωτιά. Είναι εξαιρετικά διαβρωτικό και ερεθιστικό, προκαλώντας σοβαρά εγκαύματα στα μάτια, το δέρμα, τους βλεννογόνους και την αναπνευστική οδό σε συγκεντρώσεις τόσο χαμηλές όσο
1 mg/m3.




