SF4 Μοριακή Γεωμετρία και Γωνίες Δεσμών
Η δομή της μοριακής γεωμετρίας SF4 μπορεί να προβλεφθεί χρησιμοποιώντας τις αρχές της θεωρίας VSEPR:Ένα μη δεσμευτικό μεμονωμένο ζεύγος ηλεκτρονίων καταλαμβάνει μία από τις τρεις θέσεις του ισημερινού. Ως αποτέλεσμα, υπάρχουν δύο τύποι συνδετών F στο μόριο:αξονικοί και ισημερινοί.
Η μοριακή γεωμετρία SF4 και οι γωνίες δεσμού των μορίων που έχουν τον χημικό τύπο AX4E είναι τριγωνικές διπυραμιδικές. Δείχνονται οι ισημερινοί προσανατολισμοί δύο ατόμων φθορίου που δημιουργούν δεσμούς με το άτομο θείου, ενώ φαίνονται οι αξονικές θέσεις των άλλων δύο. Επειδή το άτομο του πυρήνα έχει ένα μόνο ζεύγος ηλεκτρονίων, απωθεί το ζεύγος σύνδεσης, αλλάζοντας το σχήμα και δίνοντάς του μια όψη τραμπάλας.
ΣΗΜΑΣΙΑ ΤΗΣ ΜΟΡΙΑΚΗΣ ΓΕΩΜΕΤΡΙΑΣ SF4.
Η κατανόηση της σημασίας της μοριακής γεωμετρίας SF4 και των γωνιών δεσμού είναι πολύ σημαντική.
Τι είναι ο υβριδισμός SF4;
Ο δεσμός σθένους και ο υβριδισμός δεν συνδέονται με την υπόθεση της απώθησης ζεύγους ηλεκτρονίων κελύφους σθένους (VSEPR), παρόλο που συνήθως διδάσκονται μαζί. Το SF4 περιέχει μόνο ένα μοναχικό ζεύγος και τέσσερις δεσμούς F sigma. Το S είναι το άτομο του πυρήνα. Για να το θέσω αλλιώς, έχει τέσσερις ζώνες συγκόλλησης, η καθεμία με ένα μοναχικό ζεύγος.
Επειδή τα τροχιακά 3s στο θείο είναι πλήρως γεμάτα, αλλά τα τροχιακά 3p στο 4f δεν είναι, απαιτούνται 4 μισογεμάτα τροχιακά ή τροχιακά με ένα μόνο ηλεκτρόνιο σε κάθε τροχιακό, για να σχηματίσουν δεσμούς. Ως αποτέλεσμα, τα ηλεκτρόνια από το τροχιακό 3p διεγείρονται στα 3d τροχιακά στη διεγερμένη κατάσταση του θείου, αφήνοντας τέσσερα τροχιακά διαθέσιμα για σύνδεση με άτομα φθορίου.
Επειδή τα d τροχιακά δεν είναι απαραίτητα για αυτό και συγκρίσιμες "υπερσθενείς" ενώσεις, ο υβριδισμός είναι ένας κακός τρόπος για να συλλάβουμε το SF4. Η ιδέα αναπτύχθηκε πριν κατανοήσουμε πλήρως τον μη ακέραιο δεσμό.
Στο Sulphur, η σύνδεση πραγματοποιείται με την παραγωγή τεσσάρων απλών δεσμών με ένα μόνο ζεύγος. Ως αποτέλεσμα, μπορούμε να αναγνωρίσουμε πέντε διακριτές ζώνες πυκνότητας ηλεκτρονίων.
Τα ατομικά τροχιακά πέντε σθένους του ατόμου S υβριδοποιούνται στη μέση για να παράγουν πέντε υβριδικά τροχιακά sp3d. Στα 2p-τροχιακά, τέσσερα υβριδικά τροχιακά επικαλύπτονται, ενώ το πέμπτο έχει μόνο ένα ζεύγος. Μπορείτε να χρησιμοποιήσετε τον στερικό αριθμό για να προσδιορίσετε πόσα υβριδικά τροχιακά διαθέτει ένα άτομο. Το θείο θα χρησιμοποιεί πέντε τροχιακά:ένα τροχιακό 3s, τρία τροχιακά 3p και ένα τροχιακό 3d.
Δομή Lewis του SF4
Η δομή Lewis απεικονίζει οπτικά τη γεωμετρία του μορίου SF4 και συνδέει γωνίες και ηλεκτρόνια σθένους. Οι γραμμές αντιπροσωπεύουν δεσμούς που δημιουργούνται μεταξύ δύο ατόμων, ενώ οι τελείες αντιπροσωπεύουν ηλεκτρόνια σθένους που δεν δημιουργούν δεσμούς. Τα δεσμευτικά ζεύγη ηλεκτρονίων εμπλέκονται στο σχηματισμό δεσμών, ενώ τα μη δεσμευτικά ζεύγη ηλεκτρονίων, γνωστά και ως μοναχικά ζεύγη, δεν συμμετέχουν ούτε δημιουργούν δεσμούς.
Η συνολική ποσότητα ηλεκτρονίων στα κελύφη σθένους του SF4
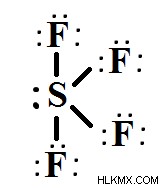
Το τετραφθοριούχο θείο αποτελείται μόνο από δύο στοιχεία:θείο και φθόριο. Το θείο είναι ένα στοιχείο VIA της ομάδας περιοδικού πίνακα με έξι ηλεκτρόνια στο τελικό του περίβλημα (φλοιό σθένους). Το φθόριο είναι ένα στοιχείο VIIA της ομάδας περιοδικού πίνακα με επτά ηλεκτρόνια στο τελικό του περίβλημα.
Στο SF4, ποια είναι η γεωμετρία ζεύγους ηλεκτρονίων για το S;
Το βασικό στοιχείο, το θείο, στο SF4, έχει έναν στερικό αριθμό 5 και διαθέτει έναν μόνο σύνδεσμο με καθένα από τα φθόριο και ένα μεμονωμένο ζεύγος. Τα ζεύγη ηλεκτρονίων θα οργανωθούν ως τριγωνική διπυραμίδα, με το μοναχικό ζεύγος στο κέντρο. Οι δύο δεσμοί στις αξονικές θέσεις θα σχηματίσουν γωνίες 90 μοιρών, ενώ εκείνοι στις θέσεις του ισημερινού θα σχηματίσουν γωνίες 120 μοιρών. Η γεωμετρία του μορίου SF4 (που ορίζεται από τη διάταξη των ατόμων) είναι ένα "βλέπε-πριόνι".
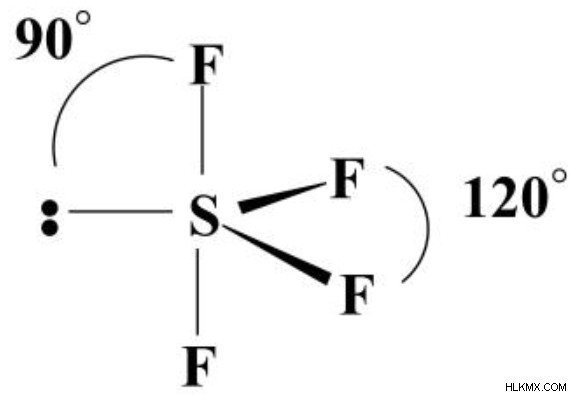
Τρεις από τους απλούς δεσμούς θα ήταν στις 90 μοίρες εάν το μοναχικό ζεύγος ήταν σε έναν από τους αξονικούς προσανατολισμούς. Όταν τα ηλεκτρόνια διαχωρίζονται μόνο κατά 90 μοίρες, η ποσότητα της απώθησης είναι σημαντικά μεγαλύτερη. Υπάρχει ουσιαστικά λιγότερη απώθηση όταν η γωνία επεκτείνεται με ανάλυση μοιρών.
Είναι το SF4 πολικό αέριο;
Η ανάλυση της ηλεκτραρνητικότητας και των δύο στοιχείων είναι μια προσέγγιση για τον προσδιορισμό του εάν τα μόρια είναι πολικά ή μη. Έχω συμπεριλάβει ένα πολύ χρήσιμο περιοδικό διάγραμμα παρακάτω που θα πρέπει να έχετε οπωσδήποτε χρήσιμο.
Η διαφορά στην ηλεκτραρνητικότητα (EN =2,98) για το SF4 είναι μεγαλύτερη από 1,7, υποδεικνύοντας ότι είναι πολικό μόριο.
Μια άλλη μέθοδος για τον προσδιορισμό του αν ένα μόριο είναι πολικό ή μη πολικό είναι να εξάγουμε τη δομή Lewis Dot της ένωσης. Το κεντρικό άτομο του τετραφθοριούχου θείου αποκτά δύο επιπλέον ηλεκτρόνια, δίνοντας στο μόριο SF4 τέσσερις ομοιοπολικούς δεσμούς και ένα ζεύγος μη συνδεδεμένων ηλεκτρονίων. Τα ηλεκτρόνια δεν κατανέμονται ομοιόμορφα όταν οι ηλεκτραρνητικότητα δεν είναι ισορροπημένες και σχηματίζονται μερικά ιοντικά φορτία. Όσο μεγαλύτερη είναι η διαφορά στην ηλεκτραρνητικότητα, τόσο πιο ιονική είναι η σύνδεση. Οι μερικώς ιοντικοί δεσμοί αναφέρονται ως πολικοί ομοιοπολικοί δεσμοί. Αυτός είναι ένας πολικός ομοιοπολικός δεσμός επειδή δείχνει μια άνιση κατανομή ηλεκτρονίων. Από την άλλη πλευρά, τα μη πολικά μόρια θα έχουν ίσο μερίδιο ηλεκτρονίων. Ως αποτέλεσμα, το SF4 είναι πολικό.
Συμπέρασμα
Γύρω από το άτομο θείου πυρήνα, το SF4 περιέχει πέντε ζώνες πυκνότητας ηλεκτρονίων (4 δεσμούς και ένα μεμονωμένο ζεύγος). Μια τριγωνική διπυραμίδα παράγει τη δομή της τραμπάλας. Το τετραφθοριούχο θείο περιέχει 34 ηλεκτρόνια σθένους, από τα οποία σχηματίζει τέσσερις ομοιοπολικούς δεσμούς και ένα μεμονωμένο ζεύγος ηλεκτρονίων στο άτομο του πυρήνα στη δομή Lewis του. Σε κάθε άτομο φθορίου, υπάρχουν τρία μόνα ζεύγη. Έχει τη μοριακή γεωμετρία AX4E και δημιουργεί ένα σχήμα τραμπάλας με τριγωνική διπυραμιδική μοριακή γεωμετρία. Το SF4 είναι πολικής φύσης και διαθέτει υβριδισμό sp3d.