Διαφορά μεταξύ ενθαλπίας και εσωτερικής ενέργειας
Κύρια διαφορά – Ενθαλπία έναντι εσωτερικής ενέργειας
Η ενέργεια μπορεί να ανταλλάσσεται μεταξύ συστημάτων και του περιβάλλοντός τους με διαφορετικό τρόπο. Η ενθαλπία και η εσωτερική ενέργεια είναι θερμοδυναμικοί όροι που χρησιμοποιούνται για να εξηγήσουν αυτήν την ανταλλαγή ενέργειας. Η ενθαλπία είναι το άθροισμα των εσωτερικών τύπων ενέργειας. Η εσωτερική ενέργεια μπορεί να είναι είτε δυναμική είτε κινητική ενέργεια. Η κύρια διαφορά μεταξύ ενθαλπίας και εσωτερικής ενέργειας είναι ότι ενθαλπία είναι η θερμότητα που απορροφάται ή εξελίσσεται κατά τη διάρκεια χημικών αντιδράσεων που συμβαίνουν σε ένα σύστημα ενώ η εσωτερική ενέργεια είναι το άθροισμα του δυναμικού και της κινητικής ενέργειας σε ένα σύστημα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Ενθαλπία
– Ορισμός, Μονάδες, Τύπος Υπολογισμού, Ιδιότητες, Παραδείγματα
2. Τι είναι η Εσωτερική Ενέργεια
– Ορισμός, Τύπος υπολογισμού, Ιδιότητες, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ της ενθαλπίας και της εσωτερικής ενέργειαςς
– Σύγκριση βασικών διαφορών
Βασικοί όροι: Ενθαλπία, Θερμότητα, Εσωτερική Ενέργεια, Θερμότητα σύντηξης, θερμότητα εξάτμισηςJoules, Κινητική ενέργεια, Δυνητική ενέργεια, Σύστημα, Θερμοδυναμική

Τι είναι η Ενθαλπία
Η ενθαλπία είναι η θερμική ενέργεια που απορροφάται ή εξελίσσεται κατά την εξέλιξη μιας χημικής αντίδρασης. Στην ενθαλπία δίνεται το σύμβολο H. Το H δείχνει την ποσότητα ενέργειας. Η μεταβολή της ενθαλπίας δίνεται ως ΔΗ όπου το σύμβολο Δ υποδηλώνει τη μεταβολή της ενθαλπίας. Η ενθαλπία δίνεται σε joules (j) ή kilo joules (kj) .
Μπορούμε να πούμε ότι η ενθαλπία είναι το άθροισμα της εσωτερικής ενέργειας ενός συστήματος. Αυτό συμβαίνει επειδή η εσωτερική ενέργεια μεταβάλλεται κατά τη διάρκεια μιας χημικής αντίδρασης και αυτή η αλλαγή μετράται ως ενθαλπία. Η ενθαλπία μιας διεργασίας που συμβαίνει σε σταθερή πίεση μπορεί να δοθεί όπως παρακάτω.
H =U + PV
Πού,
Υ είναι η ενθαλπία,
U είναι το άθροισμα της εσωτερικής ενέργειαςς
P είναι η πίεση του συστήματος
V είναι ο όγκος του συστήματος
Επομένως, η ενθαλπία είναι στην πραγματικότητα το άθροισμα της εσωτερικής ενέργειας και της ενέργειας που απαιτείται για τη διατήρηση του όγκου ενός συστήματος σε μια δεδομένη πίεση. Ο όρος "PV" υποδηλώνει την εργασία που πρέπει να γίνει στο περιβάλλον προκειμένου να δημιουργηθεί χώρος για το σύστημα.
Η μεταβολή της ενθαλπίας υποδεικνύει εάν μια συγκεκριμένη αντίδραση είναι ενδόθερμη ή εξώθερμη αντίδραση. Εάν η τιμή του ΔΗ είναι θετική, η αντίδραση είναι ενδόθερμη. Αυτό σημαίνει ότι πρέπει να δοθεί ενέργεια σε αυτό το σύστημα από έξω για να συμβεί η αντίδραση. Αν όμως το ΔH είναι αρνητική τιμή, σημαίνει ότι η αντίδραση απελευθερώνει ενέργεια προς τα έξω.
Επιπλέον, η αλλαγή της ενθαλπίας συμβαίνει στην αλλαγή φάσης ή κατάστασης των ουσιών. Για παράδειγμα, εάν ένα στερεό μετατραπεί στην υγρή του μορφή, η ενθαλπία αλλάζει. Αυτό ονομάζεται θερμότητα σύντηξης . Όταν ένα υγρό μετατρέπεται σε αέρια μορφή, η μεταβολή της ενθαλπίας ονομάζεται θερμότητα εξάτμισης .
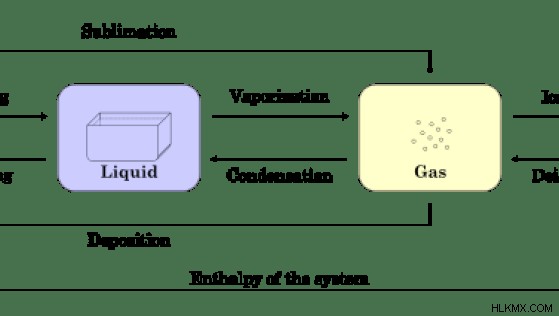
Εικόνα 01:Η αλλαγή στην κατάσταση ή τη φάση των ουσιών
Η παραπάνω εικόνα δείχνει την αλλαγή στην κατάσταση ή τη φάση μιας ουσίας σε ένα σύστημα. Εδώ, κάθε μετάβαση έχει τη δική της ενθαλπία, υποδεικνύοντας εάν αυτή η αντίδραση είναι ενδόθερμη ή εξώθερμη.
Η θερμοκρασία του συστήματος έχει μεγάλη επίδραση στην ενθαλπία. Σύμφωνα με την παραπάνω εξίσωση, η ενθαλπία μεταβάλλεται όταν αλλάζει η εσωτερική ενέργεια. Όταν αυξάνεται η θερμοκρασία, η εσωτερική ενέργεια θα αυξάνεται καθώς αυξάνεται η κινητική ενέργεια των μορίων. Στη συνέχεια, η ενθαλπία αυτού του συστήματος αυξάνεται επίσης.
Τι είναι η εσωτερική ενέργεια
Η εσωτερική ενέργεια ενός συστήματος είναι το άθροισμα της δυναμικής ενέργειας και της κινητικής ενέργειας αυτού του συστήματος. Η δυναμική ενέργεια είναι η αποθηκευμένη ενέργεια και η κινητική ενέργεια είναι η ενέργεια που παράγεται λόγω της κίνησης των μορίων. Η εσωτερική ενέργεια δίνεται από το σύμβολο U και η μεταβολή στην εσωτερική ενέργεια δίνεται ως ΔU.
Η μεταβολή της εσωτερικής ενέργειας σε σταθερή πίεση είναι ίση με την αλλαγή της ενθαλπίας σε αυτό το σύστημα. Η αλλαγή στην εσωτερική ενέργεια μπορεί να συμβεί με δύο τρόπους. Το ένα οφείλεται στη μεταφορά θερμότητας - το σύστημα μπορεί να απορροφήσει θερμότητα από το εξωτερικό ή μπορεί να απελευθερώσει θερμότητα στο περιβάλλον. Και οι δύο τρόποι μπορούν να προκαλέσουν αλλαγή της εσωτερικής ενέργειας του συστήματος. Ο άλλος τρόπος είναι κάνοντας δουλειά. Επομένως, η αλλαγή στην εσωτερική ενέργεια μπορεί να δοθεί όπως παρακάτω.
∆U =q + w
Πού,
∆U είναι η αλλαγή στην εσωτερική ενέργεια,
q είναι η θερμότητα που μεταφέρεται,
w είναι η εργασία που γίνεται πάνω ή από το σύστημα
Ωστόσο, ένα απομονωμένο σύστημα δεν μπορεί να έχει όρο ΔU επειδή η εσωτερική ενέργεια είναι σταθερή και, η μεταφορά ενέργειας είναι μηδενική και δεν γίνεται καμία εργασία. Όταν η τιμή για το ΔU είναι θετική, υποδηλώνει ότι το σύστημα απορροφά θερμότητα από το εξωτερικό και έχει γίνει εργασία στο σύστημα. Όταν η ΔU είναι αρνητική τιμή, τότε το σύστημα απελευθερώνει θερμότητα και η εργασία γίνεται από το σύστημα.
Ωστόσο, η εσωτερική ενέργεια μπορεί να υπάρχει ως δυναμική ενέργεια ή κινητική ενέργεια, αλλά όχι ως θερμότητα ή έργο. Αυτό συμβαίνει επειδή η θερμότητα και η εργασία υπάρχουν μόνο όταν το σύστημα υφίσταται αλλαγές.
Διαφορά μεταξύ ενθαλπίας και εσωτερικής ενέργειας
Ορισμός
Ενθαλπία: Η ενθαλπία είναι η θερμική ενέργεια που απορροφάται ή εξελίσσεται κατά την εξέλιξη μιας χημικής αντίδρασης.
Εσωτερική ενέργεια: Η εσωτερική ενέργεια ενός συστήματος είναι το άθροισμα της δυναμικής ενέργειας και της κινητικής ενέργειας αυτού του συστήματος.
Εξίσωση
Ενθαλπία: Η ενθαλπία δίνεται ως H = U + PV.
Εσωτερική ενέργεια: Η εσωτερική ενέργεια δίνεται ως ∆U = q + w.
Σύστημα
Ενθαλπία: Η ενθαλπία ορίζεται ως η σχέση μεταξύ του συστήματος και του περιβάλλοντος.
Εσωτερική ενέργεια: Η εσωτερική ενέργεια ορίζεται ως η συνολική ενέργεια σε ένα σύστημα.
Συμπέρασμα
Η ενθαλπία σχετίζεται με συστήματα που βρίσκονται σε επαφή με το περιβάλλον και η εσωτερική ενέργεια είναι η συνολική ενέργεια από την οποία αποτελείται ένα συγκεκριμένο σύστημα. Ωστόσο, η αλλαγή στην ενθαλπία και η αλλαγή στην εσωτερική ενέργεια είναι πολύ σημαντικές για τον προσδιορισμό του τύπου και της φύσης των χημικών αντιδράσεων που συμβαίνουν σε ένα σύστημα. Επομένως, είναι σημαντικό να κατανοήσουμε ξεκάθαρα τη διαφορά μεταξύ ενθαλπίας και εσωτερικής ενέργειας.