Σχέση μεταξύ ιόντων υδρογόνου και pH
Το pH είναι μια σημαντική παράμετρος που μετράται για τον προσδιορισμό της ποιότητας του νερού. Υποδεικνύει εάν μια πηγή νερού είναι καλής ποιότητας για χρήση για πόσιμο και άλλες ανάγκες οικιακής χρήσης. Επιπλέον, η διατήρηση του κατάλληλου pH είναι κρίσιμη και για ορισμένες χημικές αντιδράσεις. Το pH ενός συστήματος εξαρτάται από τη συγκέντρωση ιόντων υδρογόνου που υπάρχουν σε αυτό το σύστημα. Η συγκέντρωση ιόντων υδρογόνου σε ένα διάλυμα είναι η ποσότητα των ιόντων υδρογόνου (σε μονάδες mol) που υπάρχουν σε ένα λίτρο διαλύματος. Το pH είναι η λογαριθμική τιμή του αντιστρόφου της συγκέντρωσης ιόντων υδρογόνου. Αυτή είναι η σχέση μεταξύ ιόντων υδρογόνου και pH.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα ιόντα υδρογόνου
– Ορισμός, Ιδιότητες
2. Τι είναι το pH
– Ορισμός, Ιδιότητες, Κλίμακα και Μετρήσεις
3. Ποια είναι η σχέση μεταξύ ιόντων υδρογόνου και pH
– Εξήγηση με Παραδείγματα
Βασικοί όροι:οξύτητα, αλκαλικότητα, βασικότητα, ιόντα υδρογόνου, ιόν υδρονίου, pH, πρωτόνιο

Τι είναι τα ιόντα υδρογόνου
Τα ιόντα υδρογόνου είναι οι ιοντικές μορφές του στοιχείου Υδρογόνο. Αυτό δίνεται από το σύμβολο H. Ένα ιόν σχηματίζεται όταν αφαιρούνται ή προστίθενται ηλεκτρόνια σε ένα άτομο. Όταν αφαιρούνται ηλεκτρόνια από ένα άτομο, αυτό γίνεται κατιόν. Όταν προστίθενται ηλεκτρόνια σε ένα άτομο, αυτό γίνεται ανιόν. Το υδρογόνο έχει μόνο ένα ηλεκτρόνιο στα ουδέτερα άτομα του στην αέρια φάση. Το πιο σταθερό ισότοπο του υδρογόνου περιέχει ένα πρωτόνιο στον πυρήνα του. Επομένως, το θετικό φορτίο του πυρήνα (λόγω της παρουσίας πρωτονίου) εξουδετερώνεται από το μόνο ηλεκτρόνιο που έχει. Αλλά όταν αυτό το ηλεκτρόνιο αφαιρείται από το άτομο υδρογόνου, υπάρχει μόνο το θετικά φορτισμένο πρωτόνιο. Επομένως, το υδρογόνο γίνεται ιόν υδρογόνου. Έτσι, το ιόν υδρογόνου είναι μόνο ένα πρωτόνιο.
Σε υδατικά διαλύματα, αυτό το ιόν ή πρωτόνιο υδρογόνου βρίσκεται σε συνδυασμό με το H2 Μόρια Ο (νερού). Τότε ονομάζεται ιόν υδρονίου . Το σύμβολο για το ιόν υδρονίου είναι H3 O. Αυτό το σύμβολο δημιουργείται από το H-H2 O συνδυασμός.
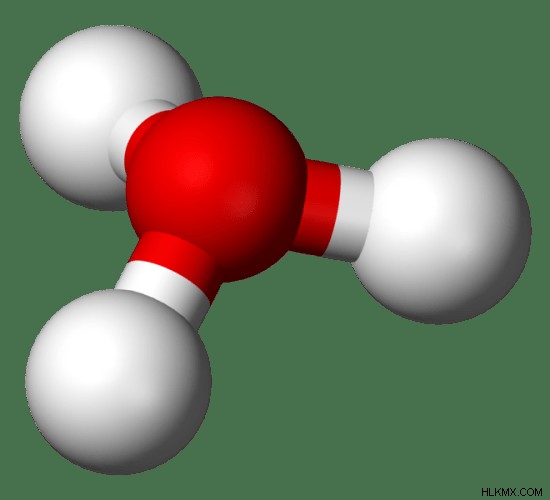
Εικόνα 1:Η χημική δομή του ιόντος υδρονίου
Η οξύτητα μιας ένωσης καθορίζεται από την ικανότητά της να απελευθερώνει ιόντα υδρογόνου (ή πρωτόνια). Επομένως, τα ισχυρά οξέα είναι ενώσεις που μπορούν να ιονίσουν πλήρως και να απελευθερώσουν όλα τα ιόντα υδρογόνου που έχουν. Τα αδύναμα οξέα είναι ενώσεις που μπορούν μερικώς να διασπαστούν στα ιόντα τους και να απελευθερώσουν μερικά από τα ιόντα υδρογόνου. Η ποσότητα των ιόντων υδρογόνου που υπάρχουν σε ένα σύστημα μπορεί να προσδιοριστεί κοιτάζοντας το pH αυτού του συστήματος. Οι τιτλοδοτήσεις οξέος-βάσης βασίζονται κυρίως σε ιόντα υδρογόνου που υπάρχουν σε ένα σύστημα. Μια βάση μπορεί να χρησιμοποιηθεί για τον προσδιορισμό του αριθμού των ιόντων υδρογόνου που υπάρχουν σε ένα υδατικό διάλυμα ενός οξέος.
Επιπλέον, τα ιόντα υδρογόνου μπορούν επίσης να υπάρχουν ανιόντα. Εφόσον το άτομο υδρογόνου έχει ένα μη ζευγαρωμένο ηλεκτρόνιο στο τροχιακό 1s, μπορεί να φέρει ένα άλλο ηλεκτρόνιο στο τροχιακό s για να ολοκληρώσει το τροχιακό και να λάβει τη διαμόρφωση ηλεκτρονίων του ηλίου (He). Στη συνέχεια, υποδεικνύεται ως H. Αυτό συμβαίνει επειδή το άτομο υδρογόνου αποτελείται από ένα πρωτόνιο και δεν υπάρχει άλλο θετικό φορτίο στο άτομο για να εξουδετερώσει το εισερχόμενο ηλεκτρόνιο.
Γενικά, το υδρογόνο τείνει να σχηματίζει το θετικό ιόν, καθώς έχει μικρότερη ηλεκτραρνητικότητα σε σύγκριση με τα περισσότερα άλλα στοιχεία. Αλλά όταν συνδέεται με στοιχεία όπως μέταλλα με πολύ χαμηλή ηλεκτραρνητικότητα από το υδρογόνο, τείνει να σχηματίζει ανιόντα αντί για κατιόντα.
Τι είναι το pH
το pH είναι η λογαριθμική τιμή του αντιστρόφου της συγκέντρωσης ιόντων υδρογόνου (ακριβέστερα η δραστηριότητα των ιόντων υδρογόνου). Το pH είναι στην πραγματικότητα μια κλίμακα που χρησιμοποιείται για τον προσδιορισμό της οξύτητας ή της βασικότητας (Αλκαλικότητα) ενός συστήματος. Η λογαριθμική τιμή οφείλεται στο ότι η συγκέντρωση ιόντων υδρογόνου σε ένα διάλυμα έχει πολύ χαμηλή ποσότητα. Για παράδειγμα, η συγκέντρωση ιόντων υδρογόνου του καθαρού νερού στους 25 C είναι περίπου 10 mol/L. Ως εκ τούτου, η συγκέντρωση των ιόντων υδρογόνου λαμβάνεται υπόψη αντί για τη δραστηριότητα και χρησιμοποιείται η λογαριθμική τιμή προκειμένου να διευκολυνθεί ο εντοπισμός και η σύγκριση αυτών των συγκεντρώσεων. Κατά τον υπολογισμό του pH, οι μονάδες συγκέντρωσης ιόντων υδρογόνου πρέπει να λαμβάνονται σε mol/L.
Η κλίμακα pH κυμαίνεται από 1 έως 14. Το pH 7 θεωρείται ως το ουδέτερο pH ενός συστήματος. Τα οξέα έχουν τιμές pH μικρότερες από 7 και οι βάσεις έχουν την τιμή pH τους πάνω από pH 7. Τα ισχυρά οξέα δείχνουν τιμές pH από 1 έως 3 ενώ τα αδύναμα οξέα δείχνουν τιμές pH από 4 έως 6. Εάν ένα σύστημα έχει τιμή pH κοντά στο 14, θεωρείται ως έντονα βασικό.
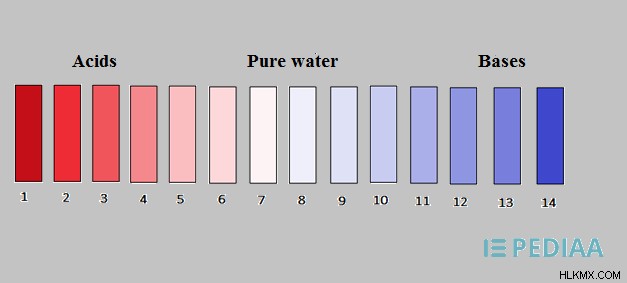
Εικόνα 2:κλίμακα pH
Το pH μπορεί να μετρηθεί χρησιμοποιώντας διάφορες μεθόδους. Τα χαρτιά λυχνίας μπορούν να χρησιμοποιηθούν για να προσδιοριστεί εάν ένα διάλυμα είναι όξινο ή βασικό. Τα χαρτιά pH μπορούν να χρησιμοποιηθούν για τον προσδιορισμό της τιμής του pH ως ακέραιου αριθμού. Μπορούν επίσης να χρησιμοποιηθούν μέθοδοι τιτλοδότησης.
Σχέση μεταξύ ιόντων υδρογόνου και pH
Υπάρχει άμεση σχέση μεταξύ ιόντων υδρογόνου και pH. Το pH ενός διαλύματος εξαρτάται από τη συγκέντρωση ιόντων υδρογόνου σε αυτό το διάλυμα. Η τιμή του pH είναι η λογαριθμική τιμή του αντιστρόφου της δραστηριότητας των ιόντων υδρογόνου. Δεδομένου ότι η συγκέντρωση των ιόντων υδρογόνου είναι συχνά πολύ χαμηλή, η δραστηριότητα των ιόντων θεωρείται ίση με τη συγκέντρωση των ιόντων υδρογόνου. Τότε, το pH είναι ο λογάριθμος του αντίστροφου της συγκέντρωσης ιόντων υδρογόνου.
pH = -log10 [aH+ ]
Όπου a είναι η δραστηριότητα.
pH = -log10 [H(aq) ]
Επομένως, υπάρχει άμεση σχέση μεταξύ του pH και της συγκέντρωσης ιόντων υδρογόνου σε ένα διάλυμα.
Συμπέρασμα
Το pH ενός διαλύματος εξαρτάται κυρίως από τη συγκέντρωση ιόντων υδρογόνου σε αυτό το διάλυμα. Η συγκέντρωση ιόντων υδρογόνου θα ποικίλλει ανάλογα με τα χημικά είδη που υπάρχουν σε αυτό το διάλυμα και τις αλλαγές στη θερμοκρασία αυτού του διαλύματος.




