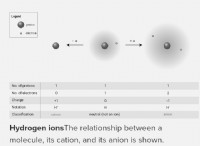
Διαφορά μεταξύ φθορίου και φθορίου
Κύρια διαφορά – Φθόριο έναντι Φθόριο
Το φθόριο είναι ένα χημικό στοιχείο που ανήκει στην ομάδα των αλογόνων. Είναι το ελαφρύτερο αλογόνο. Το φθόριο είναι ένα ανιόν που σχηματίζεται από φθόριο. Το φθόριο βρίσκεται συχνά με τη μορφή ανιόντος φθορίου σε ενώσεις. Έχει βρεθεί ότι το φθόριο είναι το 13 πιο κοινό χημικό στοιχείο στον φλοιό της γης. Τα περισσότερα βιομηχανικά σημαντικά ορυκτά είναι ο φθορίτης, ο φθοραπατίτης και ο κρυόλιθος. Όταν εξετάζουμε τις χημικές ιδιότητες του φθορίου και του φθορίου, παρουσιάζουν διαφορές στην ατομική δομή και τη χημική τους συμπεριφορά. Η κύρια διαφορά μεταξύ φθορίου και φθορίου είναι ο αριθμός των ηλεκτρονίων τους. ο αριθμός των ηλεκτρονίων στο φθόριο είναι 9 ενώ ο αριθμός των ηλεκτρονίων στο φθόριο είναι 10.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Φθόριο
– Ορισμός, Ιδιότητες, Αντιδράσεις, Εφαρμογές
2. Τι είναι το Φθόριο
– Ορισμός, Ιδιότητες, Αντιδράσεις, Εφαρμογές
3. Ποια είναι η σχέση μεταξύ φθορίου και φθορίου
– Φθόριο και φθόριο
4. Ποια είναι η διαφορά ανάμεσα στο φθόριο και το φθόριο
– Σύγκριση βασικών διαφορών
Βασικοί όροι:ανιόν, βάση, κρυόλιθος, φθοραπατίτης, φθόριο, φθόριο, φθόριος, αλογόνα 
Τι είναι το φθόριο
Το φθόριο είναι ένα χημικό στοιχείο που αντιπροσωπεύεται από το σύμβολο F. Το φθόριο τοποθετείται στην ομάδα 7 του περιοδικού πίνακα στοιχείων. Επομένως, το φθόριο ανήκει στο μπλοκ p όπου υπάρχουν αμέταλλα. Ο ατομικός αριθμός αυτού του στοιχείου είναι 9. Η διαμόρφωση ηλεκτρονίων μπορεί να δοθεί ως 1s2s2p. Δεδομένου ότι έχει 5 ηλεκτρόνια στο υπο-φλοιό p, υπάρχει ένα ασύζευκτο ηλεκτρόνιο σε ένα τροχιακό p. Επομένως, το φθόριο μπορεί εύκολα να φτιάξει το ανιόν του λαμβάνοντας ένα ηλεκτρόνιο προκειμένου να γίνει σταθερό λαμβάνοντας τη διαμόρφωση ηλεκτρονίων ευγενούς αερίου (του Νέον). Επιπλέον, το φθόριο είναι το πιο ηλεκτραρνητικό στοιχείο που έχει ανακαλυφθεί μέχρι τώρα. (Η τιμή της ηλεκτραρνητικότητας είναι 4,0).
Βρέθηκε ότι το φθόριο είναι το δέκατο τρίτο πιο άφθονο χημικό στοιχείο στον φλοιό της γης. Σε τυπική θερμοκρασία και πίεση, το φθόριο υπάρχει ως διατομικό αέριο. Μπορεί να δοθεί από τον μοριακό τύπο, F2 . Όταν είναι καθαρό, το αέριο φθόριο εμφανίζεται ως ένα ωχροκίτρινο αέριο. Έχει χαρακτηριστική (πικάντικη) οσμή. Είναι ένα εξαιρετικά αντιδραστικό αέριο. Μπορεί να επιτεθεί σε μέταλλα πολύ γρήγορα.
Το φθόριο έχει μόνο ένα φυσικό ισότοπο :Ισότοπο F. Αυτό το ισότοπο έχει 9 πρωτόνια και 10 νετρόνια στον πυρήνα του. Είναι εξαιρετικά ελκυστικό στα μαγνητικά πεδία. Το φθόριο βρίσκεται συνήθως ως συστατικό σε μέταλλα. Τα πιο κοινά και βιομηχανικά χρήσιμα ορυκτά περιλαμβάνουν φθορίτη, φθοραπατίτη και κρυόλιθο. Στον φθορίτη, το φθόριο είναι σε συνδυασμό με το ασβέστιο. Ο μοριακός τύπος του φθορίτη είναι CaF2 . Είναι η κύρια πηγή φθορίου μεταξύ άλλων μορφών ορυκτών.

Εικόνα 1:Ένα κομμάτι φθορίτη
Αντιδράσεις
- Το φθόριο αντιδρά με το αέριο υδρογόνο εκρηκτικά.
H2(g) + F2(g) → 2HF(g)
- Το αέριο φθόριο μπορεί να αντιδράσει με το νερό σχηματίζοντας αέριο HF και αέριο οξυγόνο.
2Η2 O(l) + 2F2(g) → 4HF(g) + O2(g)
- Το φθόριο μπορεί εύκολα να αναχθεί στη μόνη κατάσταση οξείδωσης που μπορεί να έχει:-1 κατάσταση οξείδωσης. Επομένως, το φθόριο δρα ως ισχυρός οξειδωτικός παράγοντας μειώνοντας τον εαυτό του.
F2(g) + 2KClO3(aq) + H2 O(l) → 2HF(g) + KClO4(aq)
- Δεδομένου ότι το φθόριο είναι πολύ αντιδραστικό, μπορεί να αντιδράσει ακόμη και με ευγενή αέρια όπως το Xenon (Xe).
Xe(g) + F2(g) → XeF2(g)
Λόγω της υψηλής ηλεκτραρνητικότητάς του, το φθόριο σχηματίζει πολικούς ομοιοπολικούς δεσμούς ή ιοντικούς δεσμούς. Στον ομοιοπολικό δεσμό, το φθόριο μπορεί να έχει μόνο απλούς δεσμούς.
Οι εφαρμογές του φθορίου περιλαμβάνουν την παραγωγή πολυμερών και πλαστικών, τα καύσιμα πυραύλων, τον κλιματισμό κ.λπ.
Τι είναι το φθόριο
Το φθόριο είναι ένα ανιόν που σχηματίζεται από το χημικό στοιχείο φθόριο. Είναι η ανηγμένη μορφή φθορίου. Στο φθόριο δίνεται το σύμβολο F. Η διαμόρφωση ηλεκτρονίων του φθορίου είναι 1s2s2p. Είναι παρόμοια με τη διαμόρφωση ηλεκτρονίων του Νέον (Ne), η οποία είναι μια σταθερή διαμόρφωση ηλεκτρονίων.
Το φθόριο δεν μπορεί να μειωθεί περαιτέρω. Η κατάσταση οξείδωσης του φθορίου είναι -1. Μπορεί να οξειδωθεί σε φθόριο μόνο όπου η κατάσταση οξείδωσης είναι μηδέν. Το φθόριο έχει αρνητικό ηλεκτρικό φορτίο επειδή το φθόριο σχηματίζεται από το φθόριο. Το φθόριο έχει 9 πρωτόνια και 9 ηλεκτρόνια. Το φθόριο σχηματίζεται όταν προστίθεται ένα ηλεκτρόνιο στο φθόριο. δεν υπάρχει επαρκής αριθμός πρωτονίων (θετικά φορτία) για να εξουδετερώσει το φορτίο του επιπλέον ηλεκτρονίου. Επομένως, το συνολικό άτομο παίρνει αρνητικό φορτίο, σχηματίζοντας ένα ανιόν.
Μερικές φορές, ο όρος φθόριο χρησιμοποιείται επίσης για την ονομασία ενώσεων που αποτελούνται από ανιόντα φθορίου. για παράδειγμα, φθοριούχο νάτριο, φθοριούχο ασβέστιο, κ.λπ. Σε ορισμένες σύνθετες ενώσεις, το φθόριο δρα ως γέφυρα συνδέτη μεταξύ δύο ατόμων (τις περισσότερες φορές, δύο μετάλλων). Συχνά, το φθόριο βρίσκεται ως ανιόν σε ιοντικές ενώσεις. Για παράδειγμα, τα αλογονίδια μετάλλων είναι πιο ιοντικά από αυτά άλλων αλογόνων.
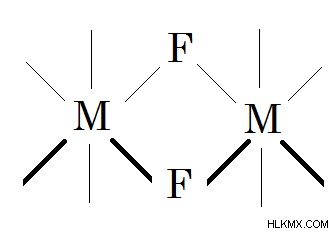
Σχήμα 02:Το φθόριο δρα ως συνδετικός παράγοντας γεφύρωσης για μεταλλικά σύμπλοκα. Στην παραπάνω εικόνα, -M- είναι το άτομο μετάλλου και -F- είναι το φθόριο.
Αντιδράσεις
Το φθόριο μπορεί να λειτουργήσει ως βάση. Σε υδατικά διαλύματα, το φθόριο μπορεί να συνδυαστεί με ένα πρωτόνιο για να σχηματίσει HF, το οποίο είναι ένα ασθενές οξύ. Είναι το συζευγμένο οξύ του φθορίου.
F(aq) + H(aq) → HF(aq)
Η βασικότητα του ανιόντος φθορίου μπορεί να δοθεί όπως παρακάτω. Η αντίδραση μεταξύ ανιόντος φθορίου και μορίου νερού σχηματίζει HF και OH ιόντα.
F(aq) + H2 O(l) → HF(aq) + OH(aq)
Εφαρμογές
Το HF (Υδροφθορικό οξύ) και τα άλατα φθορίου χρησιμοποιούνται ως πηγές φθορίου στη βιομηχανία. Χρησιμοποιούνται κυρίως στην παραγωγή φθορανθρακικού υλικού. Εκτός από αυτό, χρησιμοποιήθηκε σε βιοχημικές αναλύσεις ως ανασταλτικός παράγοντας για τη δράση των φωσφατάσης.
Σχέση μεταξύ φθορίου και φθορίου
Το φθόριο είναι το ανιόν που παράγεται από φθόριο. Το φθόριο είναι η αναγωγή του φθορίου. Το φθόριο βρίσκεται σε ενώσεις κυρίως με τη μορφή φθορίου.
Διαφορά μεταξύ φθορίου και φθορίου
Ορισμός
Φθόριο: Το φθόριο είναι ένα χημικό στοιχείο που αντιπροσωπεύεται από το σύμβολο F.
Φθόριο: Το φθόριο είναι ένα ανιόν που σχηματίζεται από το χημικό στοιχείο φθόριο.
Ηλεκτρική φόρτιση
Φθόριο: Το φθόριο είναι ουδέτερα φορτισμένο.
Φθόριο: Το φθόριο είναι αρνητικά φορτισμένο.
Αριθμός ηλεκτρονίων
Φθόριο: Το φθόριο έχει 9 ηλεκτρόνια.
Φθόριο: Το φθόριο έχει 10 ηλεκτρόνια.
Διαμόρφωση ηλεκτρονίων
Φθόριο: Η ηλεκτρονική διαμόρφωση του φθορίου είναι 1s2s2p.
Φθόριο: Η ηλεκτρονιακή διαμόρφωση του φθορίου είναι 1s2s2p.
Κατάσταση οξείδωσης
Φθόριο: Το φθόριο βρίσκεται σε κατάσταση μηδενικής οξείδωσης.
Φθόριο: Το φθόριο βρίσκεται σε κατάσταση οξείδωσης -1.
Ακτίνα
Φθόριο: Η ατομική ακτίνα του φθορίου είναι περίπου 147 μ.μ.
Φθόριο: Η ιοντική ακτίνα του φθορίου είναι περίπου 133 μ.μ.
Συμπέρασμα
Το φθόριο βρίσκεται ως συστατικό ορυκτών. Ο φθορίτης είναι η κύρια πηγή φθορίου. Αυτή είναι η διαφορά μεταξύ φθορίου και φθορίου. Το φθόριο βρίσκεται με τη μορφή φθορίου στις περισσότερες ενώσεις που περιέχουν φθόριο. Εάν όχι, το φθόριο μπορεί να βρεθεί στην αέρια φάση του ως διατομικά μόρια.