Διαφορά μεταξύ διαμοριακού και ενδομοριακού δεσμού υδρογόνου
Κύρια διαφορά – Διαμοριακός δεσμός έναντι Ενδομοριακού Υδρογόνου
Τα μόρια σχηματίζονται όταν άτομα των ίδιων στοιχείων ή διαφορετικών στοιχείων ενώνονται για να μοιραστούν ηλεκτρόνια και να δημιουργήσουν ομοιοπολικούς δεσμούς. Υπάρχουν δύο τύποι ελκτικών δυνάμεων που κρατούν τα ομοιοπολικά μόρια ενωμένα. Αυτές ονομάζονται διαμοριακές δυνάμεις και ενδομοριακές δυνάμεις. Οι διαμοριακές δυνάμεις είναι οι ελκτικές δυνάμεις που εμφανίζονται μεταξύ δύο μορίων, ενώ οι ενδομοριακές δυνάμεις εμφανίζονται μέσα στο ίδιο το μόριο. Οι δεσμοί υδρογόνου είναι ειδικοί τύποι δεσμών που σχηματίζονται σε μόρια που παράγονται από ένα άτομο υδρογόνου που μοιράζεται ηλεκτρόνια με ένα εξαιρετικά ηλεκτραρνητικό άτομο. Ο δεσμός υδρογόνου μπορεί να συμβεί τόσο ως διαμοριακές όσο και ως ενδομοριακές δυνάμεις. Η κύρια διαφορά μεταξύ του διαμοριακού και του ενδομοριακού δεσμού υδρογόνου είναι ότιο διαμοριακός δεσμός συμβαίνει μεταξύ δύο γειτονικών μορίων ενώ ο ενδομοριακός δεσμός υδρογόνου συμβαίνει μέσα στο ίδιο το μόριο.
Είναι σημαντικό να γνωρίζουμε τη λειτουργία αυτών των δύο δυνάμεων χωριστά για να κατανοήσουμε πώς διατηρούν ένα μόριο ή μια ομοιοπολική ένωση μαζί.
Αυτό το άρθρο εξηγεί,
1. Τι είναι ο δεσμός υδρογόνου;
2. Τι είναι ο Διαμοριακός Δεσμός Υδρογόνου;
– Ορισμός, χαρακτηριστικά και ιδιότητες, παραδείγματα
3. Τι είναι ο Ενδομοριακός Δεσμός Υδρογόνου;
– Ορισμός, χαρακτηριστικά και ιδιότητες, παραδείγματα
4. Ποια είναι η διαφορά μεταξύ Διαμοριακού και Ενδομοριακού Δεσμού Υδρογόνου; 
Τι είναι ο δεσμός υδρογόνου
Όταν το υδρογόνο, το οποίο είναι μέτρια ηλεκτραρνητικό, συνδέεται ομοιοπολικά με ένα ισχυρά ηλεκτραρνητικό άτομο, το ζεύγος των ηλεκτρονίων που μοιράζονται γίνεται πιο προκατειλημμένο προς το άκρως ηλεκτραρνητικό άτομο. Παραδείγματα τέτοιων ατόμων είναι τα N, O και F. Πρέπει να υπάρχει ένας δέκτης υδρογόνου και ένας δότης υδρογόνου για να σχηματιστεί ένας δεσμός υδρογόνου. Ο δότης υδρογόνου είναι το άκρως ηλεκτραρνητικό άτομο στο μόριο και ο δέκτης υδρογόνου είναι το άκρως ηλεκτραρνητικό άτομο υδρογόνου στο γειτονικό μόριο και θα πρέπει να διαθέτει ένα μόνο ζεύγος ηλεκτρονίων.
Ο δεσμός υδρογόνου μπορεί να εμφανιστεί είτε μεταξύ δύο μορίων είτε εντός του μορίου. Αυτοί οι δύο τύποι είναι γνωστοί ως διαμοριακός δεσμός υδρογόνου και ενδομοριακός δεσμός υδρογόνου αντίστοιχα.
Τι είναι ο Διαμοριακός Δεσμός Υδρογόνου
Ο διαμοριακός δεσμός υδρογόνου μπορεί να συμβεί μεταξύ όμοιων ή διαφορετικών μορίων. Η θέση του ατόμου δέκτη θα πρέπει να είναι σωστά προσανατολισμένη έτσι ώστε να μπορεί να αλληλεπιδρά με τον δότη.
Ας δούμε ένα μόριο νερού για να κατανοήσουμε ξεκάθαρα το σενάριο.
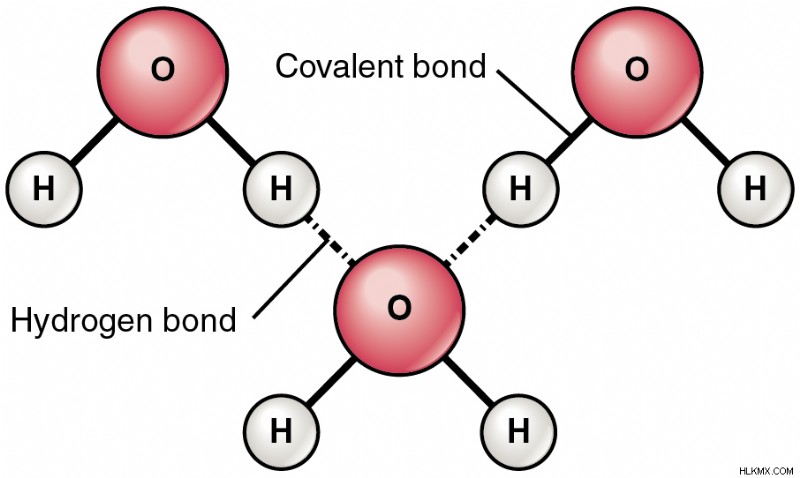
Εικόνα 1:Δεσμοί υδρογόνου σε μόριο νερού
Το ζεύγος ηλεκτρονίων που μοιράζονται τα άτομα Η και Ο έλκονται περισσότερο προς το άτομο οξυγόνου. Ως εκ τούτου, τα άτομα Ο έχουν ένα ελαφρύ αρνητικό φορτίο σε σύγκριση με το άτομο Η. Το άτομο Ο απεικονίζεται ως δ- και το άτομο Η απεικονίζεται ως δ+. Όταν ένα δεύτερο μόριο νερού πλησιάζει το πρώτο, σχηματίζεται ηλεκτροστατικός δεσμός μεταξύ του ατόμου δ-Ο ενός μορίου νερού με το άτομο δ+ Η του άλλου. Τα άτομα οξυγόνου στα μόρια συμπεριφέρονται ως δότης (Β) και δέκτης (Α) όπου το ένα άτομο Ο δωρίζει υδρογόνο στο άλλο.
Το νερό έχει πολύ ιδιαίτερες ιδιότητες λόγω του δεσμού υδρογόνου. Είναι καλός διαλύτης και έχει υψηλό σημείο βρασμού και υψηλή επιφανειακή τάση. Επιπλέον, ο πάγος στους 4 ̊C έχει μικρότερη πυκνότητα από το νερό. Ως εκ τούτου, ο πάγος επιπλέει σε υγρό νερό προστατεύοντας την υδρόβια ζωή από κάτω κατά τη διάρκεια του χειμώνα. Λόγω αυτών των χαρακτηριστικών του νερού, ονομάζεται παγκόσμιος διαλύτης και παίζει σημαντικό ρόλο στη διατήρηση της ζωής στη γη.
Τι είναι ο Ενδομοριακός Δεσμός Υδρογόνου
Αν ένας δεσμός υδρογόνου εμφανίζεται σε δύο λειτουργικές ομάδες του ίδιου μορίου, ονομάζεται ενδομοριακός δεσμός υδρογόνου. Αυτό συμβαίνει όταν ο δότης και ο δέκτης υδρογόνου βρίσκονται και οι δύο μέσα στο ίδιο μόριο.

Εικόνα 2:Δομή της ο-Νιτροφαινόλης (ορθο-Νιτροφαινόλης) με ενδομοριακό δεσμό υδρογόνου
Στο μόριο O-nitro φαινόλης, το άτομο O στην ομάδα –OH είναι πιο ηλεκτραρνητικό από το H και ως εκ τούτου το δ-. Το άτομο H, από την άλλη πλευρά, είναι δ+. Επομένως, το άτομο Ο στην ομάδα –ΟΗ δρα ως δότης Η ενώ το άτομο Ο στην ομάδα νίτρο δρα ως ο δέκτης Η.
Διαφορά μεταξύ διαμοριακού και ενδομοριακού δεσμού υδρογόνου
Σχηματισμός δεσμού
Δεσμός διαμοριακού υδρογόνου: Ο διαμοριακός δεσμός υδρογόνου συμβαίνει μεταξύ δύο γειτονικών μορίων.
Ενδομοριακός δεσμός υδρογόνου: Ο ενδομοριακός δεσμός υδρογόνου συμβαίνει μέσα στο ίδιο το μόριο.
Φυσικές ιδιότητες
Δεσμός διαμοριακού υδρογόνου: Ο διαμοριακός δεσμός υδρογόνου έχει υψηλά σημεία τήξης και βρασμού και χαμηλή τάση ατμών.
Ενδομοριακός δεσμός υδρογόνου: Ο ενδομοριακός δεσμός υδρογόνου έχει χαμηλά σημεία τήξης και βρασμού και υψηλή τάση ατμών.
Σταθερότητα
Δεσμός διαμοριακού υδρογόνου: Η σταθερότητα είναι σχετικά υψηλή.
Ενδομοριακός δεσμός υδρογόνου: Η σταθερότητα είναι συγκριτικά χαμηλή.
Παραδείγματα
Δεσμός διαμοριακού υδρογόνου: Το νερό, η μεθυλική αλκοόλη, η αιθυλική αλκοόλη και η ζάχαρη είναι παραδείγματα διαμοριακών δεσμών υδρογόνου.
Ενδομοριακός δεσμός υδρογόνου: Η Ο-νιτροφαινόλη και το σαλικυλικό οξύ είναι παραδείγματα ενδομοριακών δεσμών υδρογόνου.
Σύνοψη – Διαμοριακός έναντι Ενδομοριακός Δεσμός Υδρογόνου
Οι ενώσεις με διαμοριακούς δεσμούς υδρογόνου είναι πιο σταθερές από τις ενώσεις με ενδομοριακούς δεσμούς υδρογόνου. Οι διαμοριακοί δεσμοί υδρογόνου είναι υπεύθυνοι για τη σύνδεση ενός μορίου με το άλλο και τη διατήρησή τους συνδεδεμένα μεταξύ τους. Σε αντίθεση με αυτό, όταν συμβαίνει ενδομοριακός δεσμός υδρογόνου, τα μόρια είναι λιγότερο διαθέσιμα για αλληλεπίδραση μεταξύ τους και τα μόρια έχουν λιγότερη τάση να κολλάνε μεταξύ τους. Αυτό οδηγεί σε μείωση του σημείου βρασμού και του σημείου τήξης. Επιπλέον, τα μόρια με ενδομοριακούς δεσμούς υδρογόνου είναι πιο πτητικά και έχουν συγκριτικά υψηλότερη τάση ατμών.
Οι ενώσεις με διαμοριακούς δεσμούς υδρογόνου είναι εύκολα διαλυτές σε ενώσεις παρόμοιας φύσης, ενώ οι ενώσεις με ενδομοριακούς δεσμούς υδρογόνου δεν διαλύονται εύκολα.
«Δεσμός υδρογόνου». Chemistry LibreTexts . Libretexts, 21 Ιουλίου 2016. Web. 07 Φεβ. 2017.
«Δεσμός Υδρογόνου:Αποδέκτες και Δότες». University of Wisconsin, n.d. Ιστός. 07 Φεβ. 2017.
«Δεσμός και ενδομοριακός δεσμός υδρογόνου σε αλκοόλες, καρβοξυλικά οξέα και άλλα μόρια και η σημασία τους». Οργανική Χημεία . Ν.π., Οκτ. 2012. Web. 07 Φεβ. 2017.
«Ισχύς ενδομοριακών έναντι διαμοριακών δεσμών υδρογόνου». Chemistry Stack Exchange . N.p., 2013. Web. 07 Φεβ. 2017.
Ευγενική προσφορά εικόνας:
“O-Nitrophenol Wasserstoffbrücke” By NEUROtiker – Ίδιο έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia
“210 δεσμοί υδρογόνου μεταξύ μορίων νερού-01” από το OpenStax College – Anatomy &Physiology, Connexions Web site. (CC BY 3.0) μέσω Commons Wikimedia




