Διαφορά μεταξύ αντιδραστηρίου και αντιδραστηρίου
Κύρια διαφορά – αντιδραστήριο έναντι αντιδραστηρίου
Μια χημική αντίδραση περιλαμβάνει την αντίδραση μεταξύ δύο ή περισσότερων ενώσεων για να δημιουργηθούν μία ή περισσότερες νέες ενώσεις. Με άλλα λόγια, χημική αντίδραση είναι η αλλαγή των αντιδρώντων για να σχηματιστούν προϊόντα. Αυτά τα αντιδρώντα μπορεί να είναι σε στερεή φάση, υγρή φάση ή αέρια φάση. Ο όρος αντιδραστήριο χρησιμοποιείται για να περιγράψει έναν τύπο αντιδραστηρίων. Τα αντιδραστήρια προστίθενται σε ένα μείγμα αντίδρασης για την εξέλιξη της αντίδρασης. Ωστόσο, σε αντίθεση με τα αντιδρώντα, τα αντιδραστήρια δεν μετατρέπονται απαραίτητα σε κάποια άλλη ένωση. Έτσι, η κύρια διαφορά μεταξύ αντιδραστηρίου και αντιδραστηρίου είναι ότι τα αντιδραστήρια καταναλώνονται σε χημικές αντιδράσεις, ενώ τα αντιδραστήρια δεν καταναλώνονται απαραίτητα κατά την εξέλιξη μιας αντίδρασης.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ένα Reactant
– Ορισμός, Επεξήγηση Ιδιοτήτων με Παραδείγματα
2. Τι είναι ένα Αντιδραστήριο
– Ορισμός, Επεξήγηση Ιδιοτήτων με Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ αντιδραστηρίου και αντιδραστηρίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ενέργεια ενεργοποίησης, δείκτης, προϊόν, αντιδρών, αντιδραστήριο
Τι είναι το Reactant
Τα αντιδρώντα είναι το αρχικό υλικό που υφίσταται αλλαγές κατά τη διάρκεια μιας χημικής αντίδρασης. Τα αντιδρώντα καταναλώνονται σε μια χημική αντίδραση. Οι χημικοί δεσμοί στις αντιδρώντες ενώσεις σπάνε για να σχηματιστούν νέοι δεσμοί, δημιουργώντας μια νέα ένωση. Αυτή η νέα ένωση ονομάζεται προϊόν της αντίδρασης.
Τα μόρια των αντιδραστηρίων μπορεί να βρίσκονται σε στερεή, υγρή ή αέρια φάση. Μερικές φορές, τα αντιδρώντα που βρίσκονται σε διαφορετικές φυσικές καταστάσεις μπορεί να αντιδράσουν μεταξύ τους για να σχηματίσουν προϊόντα. Μια χημική εξίσωση δείχνει τα αντιδρώντα και το προϊόν μιας χημικής αντίδρασης. Μια χημική εξίσωση χρησιμοποιεί ένα βέλος για να υποδείξει την κατεύθυνση της αντίδρασης από την κεφαλή του βέλους. Τα αντιδρώντα βρίσκονται στην αριστερή πλευρά του βέλους, ενώ τα προϊόντα βρίσκονται στη δεξιά πλευρά.
Κατά την εξέταση της κινητικής των χημικών αντιδράσεων, η δυναμική ενέργεια των προϊόντων καθορίζεται από τον τύπο της αντίδρασης. Εάν η αντίδραση είναι εξώθερμη αντίδραση, τότε τα αντιδρώντα βρίσκονται σε υψηλό επίπεδο ενέργειας από αυτό των προϊόντων. Εάν η αντίδραση είναι ενδόθερμη, τότε τα αντιδρώντα βρίσκονται σε χαμηλότερο ενεργειακό επίπεδο από αυτό των προϊόντων.
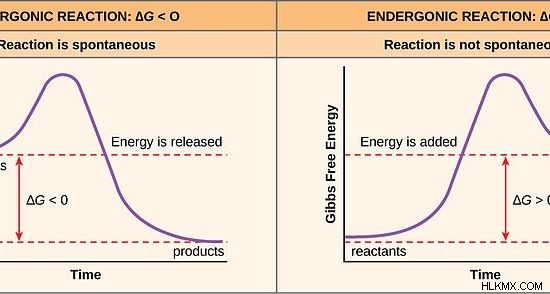
Εικόνα 1:Εξώθερμες και Ενδόθερμες Αντιδράσεις
Ωστόσο, υπάρχουν ορισμένα στοιχεία και ενώσεις που δεν θα δράσουν ποτέ ως αντιδρώντα λόγω της έλλειψης αντιδραστικότητάς τους. Ονομάζονται αδρανείς ενώσεις. Όμως ορισμένα στοιχεία και ενώσεις μπορεί να δράσουν ως αντιδρώντα υπό ακραίες συνθήκες. Για παράδειγμα, τα ευγενή αέρια δεν γίνονται αντιδρώντα καθώς είναι απολύτως σταθερά σε τυπικές συνθήκες θερμοκρασίας και πίεσης. Αλλά μερικά από αυτά τα ευγενή αέρια μπορούν να γίνουν αντιδραστήρια σε ακραίες συνθήκες. Π.χ.:Το ξένο (Xe) μπορεί να αντιδράσει με αέριο φθόριο.
Τι είναι το Αντιδραστήριο
Ένα αντιδραστήριο είναι μια ένωση που προστίθεται σε ένα σύστημα για να προκαλέσει μια χημική αντίδραση. Αυτό το αντιδραστήριο μπορεί να καταναλωθεί ή να μην καταναλωθεί στην αντίδραση. Εάν καταναλωθεί κατά τη διάρκεια της αντίδρασης, τότε αυτό το αντιδραστήριο ονομάζεται αντιδραστήριο. Αλλά μερικές φορές τα αντιδραστήρια χρησιμοποιούνται για την έναρξη μιας αντίδρασης, για τη μέτρηση της αντίδρασης ή για την ενίσχυση μιας αντίδρασης. Ένα αντιδραστήριο μπορεί να είναι σε στερεή ή υγρή φάση πριν το προσθέσετε σε ένα μείγμα αντίδρασης.
Για παράδειγμα, σε αντιδράσεις οξέος-βάσης, χρησιμοποιούνται αντιδραστήρια δεικτών για τον προσδιορισμό του τελικού σημείου της αντίδρασης. Αυτό το αντιδραστήριο δίνει μια αλλαγή χρώματος στο τελικό σημείο. Μερικές φορές, τα αντιδραστήρια καταλύτη χρησιμοποιούνται για την ενίσχυση μιας χημικής αντίδρασης. Αυτοί οι καταλύτες μπορούν να μειώσουν την ενέργεια ενεργοποίησης της αντίδρασης.

Υπάρχουν αντιδραστήρια με συγκεκριμένα ονόματα που χρησιμοποιούνται για συγκεκριμένους σκοπούς. Για παράδειγμα, το αντιδραστήριο Grignard χρησιμοποιείται στη σύνθεση αλδεϋδών ή κετονών. Μερικές φορές, το χρησιμοποιημένο αντιδραστήριο μπορεί να ανακτηθεί μετά την ολοκλήρωση της αντίδρασης. Όμως, το αντιδραστήριο χρησιμοποιείται μερικές φορές από την αντίδραση ως αντιδραστήριο. Τότε δεν μπορεί να ανακτηθεί για περαιτέρω χρήση.
Τα αντιδραστήρια αξιολογούνται όταν παράγονται. Αυτό ονομάζεται «βαθμολόγηση αντιδραστηρίων». Αυτή η ταξινόμηση αντιδραστηρίου υποδεικνύει την καθαρότητα του αντιδραστηρίου και πού να χρησιμοποιηθεί αυτό το αντιδραστήριο. Ορισμένα αντιδραστήρια αποθηκεύονται σε σκούρα μπουκάλια. Αυτό συμβαίνει επειδή αυτά τα αντιδραστήρια είναι ευαίσθητα στο ηλιακό φως και μπορούν να διασπαστούν παρουσία φωτός. Αλλά άλλα αντιδραστήρια είναι ασφαλή για αποθήκευση σε διαφανείς φιάλες.
Διαφορά μεταξύ αντιδραστηρίου και αντιδραστηρίου
Ορισμός
Αντιδρόν: Τα αντιδρώντα είναι τα αρχικά υλικά που υφίστανται αλλαγές κατά τη διάρκεια μιας χημικής αντίδρασης.
Αντιδραστήριο: Τα αντιδραστήρια είναι οι ενώσεις που προστίθενται σε ένα σύστημα για να προκαλέσουν χημική αντίδραση.
Κατανάλωση
Αντιδρόν: Τα αντιδρώντα ουσιαστικά καταναλώνονται σε χημικές αντιδράσεις.
Αντιδραστήριο: Τα αντιδραστήρια δεν καταναλώνονται απαραίτητα σε χημικές αντιδράσεις.
Εφαρμογή
Αντιδρόν: Τα αντιδρώντα χρησιμοποιούνται ως πρώτη ύλη για μια χημική αντίδραση.
Αντιδραστήριο: Τα αντιδραστήρια χρησιμοποιούνται για τη μέτρηση, την ενίσχυση ή την έναρξη μιας χημικής αντίδρασης.
Συμπέρασμα
Οι όροι αντιδραστήριο και αντιδραστήριο χρησιμοποιούνται εναλλακτικά, καθώς τα αντιδραστήρια μερικές φορές καταναλώνονται κατά τη διάρκεια μιας χημικής αντίδρασης. Όμως, τα αντιδραστήρια μπορούν συχνά να διακρίνονται από τα αντιδρώντα ανάλογα με τις εφαρμογές τους. Ωστόσο, η κύρια διαφορά μεταξύ αντιδραστηρίου και αντιδραστηρίου είναι ότι τα αντιδραστήρια καταναλώνονται σε χημικές αντιδράσεις, ενώ τα αντιδραστήρια δεν καταναλώνονται απαραίτητα κατά την εξέλιξη μιας αντίδρασης.