Διαφορά μεταξύ εξάχνωσης και εξάτμισης
Κύρια διαφορά – Εξάχνωση έναντι εξάτμισης
Η εξάχνωση και η εξάτμιση είναι όροι που χρησιμοποιούνται για να περιγράψουν τις μεταβάσεις φάσης της ύλης. Η φάση της ύλης είναι η μορφή της ύλης όπου οι ιδιότητες της ύλης είναι παντού ομοιόμορφες. Οι τρεις κύριες φάσεις της ύλης είναι η στερεά φάση, η υγρή φάση και η αέρια φάση. Μια μετάβαση φάσης είναι η μετατροπή της φάσης της ύλης από τη μια φάση στην άλλη. Η εξάχνωση είναι η μετάβαση της ύλης από στερεά σε αέρια φάση. Η εξάτμιση είναι η μετάβαση της ύλης από την υγρή φάση στην αέρια φάση. Αυτή είναι η κύρια διαφορά μεταξύ εξάχνωσης και εξάτμισης.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Sublimation
– Ορισμός, Μηχανισμός, Παραδείγματα
2. Τι είναι η εξάτμιση
– Ορισμός, Μηχανισμός, Παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ εξάχνωσης και εξάτμισης
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά ανάμεσα στην εξάχνωση και την εξάτμιση
– Σύγκριση βασικών διαφορών
Βασικοί όροι:εξάτμιση, αέρια φάση, υγρή φάση, ύλη, φάση, μετάβαση φάσης, στερεή φάση, εξάχνωση, τριπλό σημείο
Τι είναι η Εξάχνωση
Η εξάχνωση είναι η μετάβαση της στερεάς φάσης σε αέρια φάση. Κατά τη διάρκεια αυτής της μετάβασης φάσης, η ύλη δεν περνά από υγρή φάση. Το στερεό μετατρέπεται απευθείας σε αέριο. Αυτή η αντίδραση είναι μια ενδόθερμη αντίδραση αφού οι χημικοί δεσμοί μεταξύ των μορίων θα πρέπει να διασπαστούν για να απελευθερωθούν στον αέρα. Δεδομένου ότι η ενέργεια απελευθερώνεται όταν σχηματίζονται χημικοί δεσμοί, θα πρέπει να δοθεί ενέργεια για τη διάσπασή τους. Επομένως, είναι ενδόθερμος. Αυτή η ενέργεια υπολογίζεται ως η ενθαλπία της εξάχνωσης.
Η εξάχνωση συμβαίνει σε θερμοκρασίες και πιέσεις κάτω από το τριπλό σημείο μιας ουσίας. Το τριπλό σημείο μιας ουσίας είναι η θερμοκρασία και η πίεση στην οποία υπάρχει η ουσία και στις τρεις φάσεις (στερεά φάση, υγρή φάση και αέρια φάση). Κάτω από το τριπλό σημείο, το στερεό νερό εξαχνώνεται, μετατρέπεται απευθείας σε αέριο με αύξηση θερμοκρασίας και δεν περνά ποτέ από την υγρή φάση.

Εικόνα 1:Εξάχνωση ξηρού πάγου
Τα παραδείγματα εξάχνωσης περιλαμβάνουν ξηρό πάγο που μετατρέπεται σε αέριο διοξείδιο του άνθρακα σε θερμοκρασία και πίεση δωματίου. Το ναφθαλίνιο είναι μια οργανική ένωση που εξαχνώνεται εύκολα σε τυπική θερμοκρασία και πίεση.
Τι είναι η εξάτμιση
Η εξάτμιση είναι η μετάβαση της υγρής φάσης σε αέρια φάση. Αυτή είναι μια ενδόθερμη διαδικασία. Οι διαμοριακές δυνάμεις μεταξύ των μορίων του υγρού πρέπει να διασπαστούν για να σχηματιστεί ο ατμός του. Αυτή η αντίδραση απαιτεί ενέργεια. Επομένως, είναι μια ενδόθερμη αντίδραση. Αυτή είναι η αντίθετη αντίδραση της συμπύκνωσης. Η εξάτμιση σχετίζεται άμεσα με τη θερμοκρασία. Όταν αυξάνεται η θερμοκρασία, αυξάνεται και ο ρυθμός εξάτμισης.

Εικόνα 2:Εξάτμιση νερού από την επιφάνεια
Η εξάτμιση ενός υγρού συμβαίνει στην επιφάνεια του υγρού. Τα μόρια κοντά στην επιφάνεια του υγρού έχουν μικρή ποσότητα διαμοριακών δυνάμεων σε σύγκριση με τα μόρια στη μέση ή στον πυθμένα του υγρού. Επομένως τα μόρια στην επιφάνεια μπορούν να απελευθερωθούν εύκολα. Αυτά τα μόρια είναι τα πρώτα που μετατρέπονται στην αέρια φάση.
Υπάρχουν διάφοροι παράγοντες που επηρεάζουν τον ρυθμό εξάτμισης. Μερικοί από αυτούς τους παράγοντες δίνονται παρακάτω.
- Η συγκέντρωση της ουσίας στον αέρα – εάν υπάρχει υψηλή συγκέντρωση της ουσίας που εξατμίζεται στον αέρα, τότε η εξάτμιση γίνεται αργά.
- Ο ρυθμός ροής του αέρα – υψηλότερος ρυθμός ροής αυξάνει την εξάτμιση.
- Διαμοριακές δυνάμεις – εάν οι διαμοριακές δυνάμεις είναι ισχυρότερες, τότε η ενθαλπία της εξάτμισης είναι υψηλή. Τότε η εξάτμιση είναι αργή.
- Επιφάνεια – μια μεγάλη επιφάνεια είναι χρήσιμη για μεγαλύτερη εξάτμιση.
Ομοιότητες μεταξύ εξάχνωσης και εξάτμισης
- Τόσο η εξάχνωση όσο και η εξάτμιση παράγουν ένα αέριο στο τέλος.
- Και τα δύο είναι ενδόθερμα
- Και στις δύο διαδικασίες, οι διαμοριακές δυνάμεις διασπώνται προκειμένου να απελευθερωθούν τα μόρια.
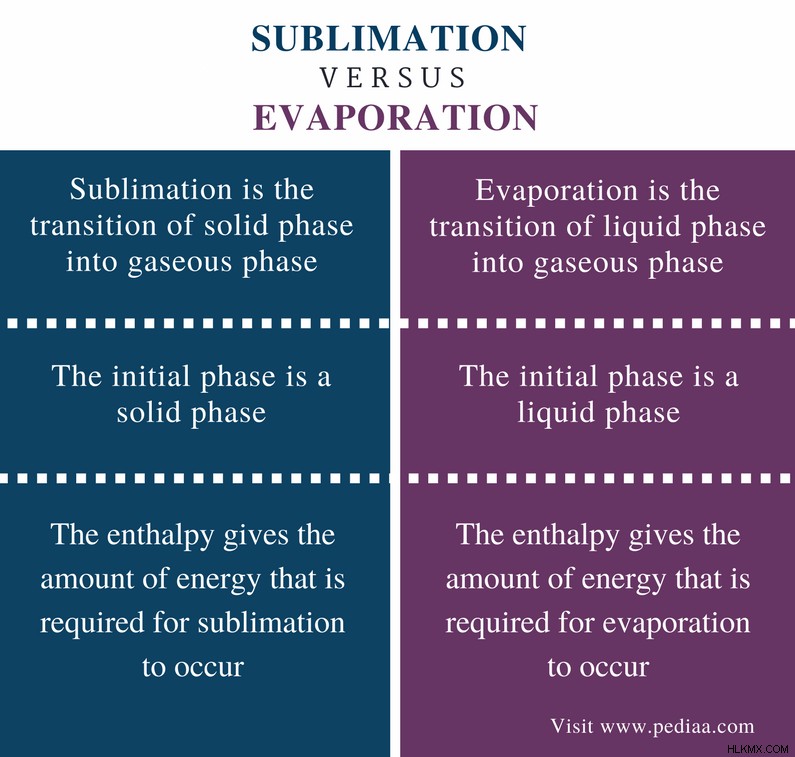
Διαφορά μεταξύ εξάχνωσης και εξάτμισης
Ορισμός
Εξάχνωση: Η εξάχνωση είναι η μετάβαση της στερεάς φάσης σε αέρια φάση.
Εξάτμιση: Η εξάτμιση είναι η μετάβαση της υγρής φάσης σε αέρια φάση.
Αρχική φάση
Εξάχνωση: Η αρχική φάση για την εξάχνωση είναι μια συμπαγής φάση.
Εξάτμιση: Η αρχική φάση για την εξάτμιση είναι μια υγρή φάση.
Ενθαλπία
Εξάχνωση: Η ενθαλπία της εξάχνωσης δίνει την ποσότητα ενέργειας που απαιτείται για να συμβεί η εξάχνωση.
Εξάτμιση: Η ενθαλπία της εξάτμισης δίνει την ποσότητα ενέργειας που απαιτείται για να συμβεί η εξάτμιση.
Συμπέρασμα
Η εξάχνωση και η εξάτμιση είναι όροι που χρησιμοποιούνται για την ονομασία μεταπτώσεων φάσης της ύλης. Αν και και οι δύο αυτές διαδικασίες περιγράφουν τη μετατροπή της ύλης στην αέρια φάση, οι όροι είναι διαφορετικοί μεταξύ τους. Η κύρια διαφορά μεταξύ της εξάχνωσης και της εξάτμισης είναι ότι η εξάχνωση είναι η μετάβαση φάσης από στερεό σε αέριο ενώ η εξάτμιση είναι η μετάβαση φάσης από υγρό σε αέριο.




