Διαφορά μεταξύ μοριακής και σειράς αντίδρασης
Κύρια διαφορά – Μοριακότητα έναντι Σειράς Αντίδρασης
Ο ρυθμός μιας χημικής αντίδρασης μπορεί να εξαρτάται κυρίως από τη θερμοκρασία και την πίεση του συστήματος, τη συγκέντρωση των αντιδρώντων που υπάρχουν, την παρουσία ή την απουσία καταλυτών και τη φύση των αντιδρώντων. Ωστόσο, ο ρυθμός της αντίδρασης υπολογίζεται λαμβάνοντας υπόψη το στάδιο προσδιορισμού της ταχύτητας. Ορισμένες χημικές αντιδράσεις έχουν μόνο ένα στάδιο, αλλά ορισμένες αντιδράσεις συμβαίνουν σε διάφορα στάδια. Σε αυτή την περίπτωση, ο ρυθμός της αντίδρασης καθορίζεται από το πιο αργό βήμα. Η μοριακότητα και η σειρά αντίδρασης είναι δύο όροι που χρησιμοποιούνται σχετικά με τον ρυθμό των αντιδράσεων. Η κύρια διαφορά μεταξύ μοριακής και σειράς αντίδρασης είναι ότι m Η οφθαλμικότητα είναι μια θεωρητική έννοια, ενώ η σειρά αντίδρασης μπορεί να προσδιοριστεί πειραματικά.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Μοριακότητα
– Ορισμός, Επεξήγηση με Παραδείγματα
2. Τι είναι η σειρά αντίδρασης
– Ορισμός, Επεξήγηση με Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ μοριακής και σειράς αντίδρασης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Διμοριακή, Αντίδραση Πρώτης Τάξης, Μοριακότητα, Σειρά αντίδρασης, Αντιδράσεις Δεύτερης Τάξης, Τριμοριακή, Μονομοριακή, Αντιδράσεις μηδενικής τάξης

Τι είναι η Molecularity
Η μοριακή ικανότητα είναι ο αριθμός των μορίων ή ιόντων που συμμετέχουν στο βήμα προσδιορισμού του ρυθμού. Το βήμα προσδιορισμού της ταχύτητας είναι το πιο αργό βήμα μεταξύ των άλλων σταδίων του μηχανισμού αντίδρασης. Το πιο αργό βήμα θεωρείται ως το βήμα προσδιορισμού της ταχύτητας, επειδή ο συνολικός ρυθμός αντίδρασης θα αυξανόταν εάν αυξηθεί ο ρυθμός του βραδύτερου βήματος. Η μοριακότητα της αντίδρασης ονομάζεται σύμφωνα με τον αριθμό των μορίων ή ιόντων που συμμετέχουν στο βήμα προσδιορισμού του ρυθμού.
Μονομοριακές Αντιδράσεις
Στις μονομοριακές αντιδράσεις, ένα μόνο μόριο υφίσταται αλλαγές. Στη συνέχεια, η εξίσωση για το βήμα προσδιορισμού του ρυθμού έχει μόνο ένα αντιδρών.
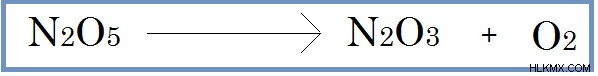
Εικόνα 01:Η μετατροπή του N2 O5 σε N2 O3 και O2 είναι Μονομοριακός
Διμοριακές Αντιδράσεις
Αυτές οι αντιδράσεις περιλαμβάνουν δύο αντιδρώντα στο στάδιο προσδιορισμού του ρυθμού.

Εικόνα 2:Μια διμοριακή αντίδραση
Τριμοριακές Αντιδράσεις
Αυτές οι αντιδράσεις περιλαμβάνουν τρία αντιδρώντα στο στάδιο προσδιορισμού του ρυθμού μιας χημικής αντίδρασης.
Τι είναι Order of Reaction
Η σειρά αντίδρασης μπορεί να οριστεί ως το άθροισμα των δυνάμεων στις οποίες αυξάνονται οι συγκεντρώσεις των αντιδρώντων στην εξίσωση του νόμου ταχύτητας. Ο νόμος του ρυθμού είναι η εξίσωση που δίνει τον ρυθμό αντίδρασης με τη χρήση συγκεντρώσεων αντιδρώντων και σταθερών παραμέτρων όπως η σταθερά ταχύτητας.
Η σειρά αντίδρασης είναι το άθροισμα των εκθετών του νόμου του ρυθμού. Η σειρά της αντίδρασης μπορεί να είναι ή όχι ίση με τους στοιχειομετρικούς συντελεστές κάθε αντιδρώντος. Επομένως, η σειρά της αντίδρασης θα πρέπει να καθοριστεί πειραματικά. Η σειρά αντίδρασης είναι μια ποσοτική μέτρηση σχετικά με την ταχύτητα μιας αντίδρασης. Σε αντίθεση με τη μοριακότητα, η σειρά αντίδρασης μπορεί να δοθεί σε κλασματικές τιμές ή ακέραιους αριθμούς. Η σειρά αντίδρασης μπορεί επίσης να είναι μηδέν. Αυτό σημαίνει ότι ο ρυθμός αντίδρασης είναι ανεξάρτητος από τη συγκέντρωση των αντιδρώντων. Ας εξετάσουμε ένα παράδειγμα.
aA + bB + cC → dD + eE
Ο νόμος του ρυθμού της παραπάνω αντίδρασης είναι,
R = k [A][B][C]
Πού,
R είναι ο ρυθμός της αντίδρασης
Α, Β και Γ είναι αντιδρώντα
Το P, το q και το r είναι τάξεις αντίδρασης σε A, B και C, αντίστοιχα.
Η σειρά της αντίδρασης είναι ίση με το άθροισμα των p+q+r.
Οι τιμές των p, q και r πρέπει να καθοριστούν πειραματικά. Μερικές φορές, αυτές οι τιμές μπορεί να είναι ίσες με τους στοιχειομετρικούς συντελεστές κάθε αντιδρώντος, αλλά μερικές φορές μπορεί να μην είναι. Η σειρά αντίδρασης υπολογίζεται λαμβάνοντας υπόψη τη συνολική αντίδραση, όχι μόνο τον προσδιορισμό του ρυθμού ή το βραδύτερο βήμα. Ανάλογα με τη σειρά αντίδρασης, μπορεί να υπάρχουν διάφοροι τύποι αντιδράσεων.
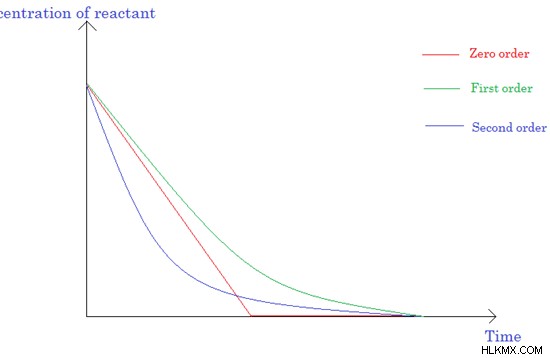
Εικόνα 3:Γράφημα συγκέντρωσης αντιδρώντων έναντι χρόνου αντίδρασης
Αντιδράσεις μηδενικής τάξης
Ο ρυθμός μιας αντίδρασης μηδενικής τάξης είναι ανεξάρτητος από τις συγκεντρώσεις των αντιδρώντων.
Αντιδράσεις πρώτης τάξης
Στις αντιδράσεις πρώτης τάξης, ο ρυθμός της αντίδρασης εξαρτάται από τη συγκέντρωση μόνο ενός αντιδραστηρίου. Αυτό αντιστοιχεί σε μια μονομοριακή αντίδραση.
Αντιδράσεις δεύτερης τάξης
Ο ρυθμός αντίδρασης των αντιδράσεων δεύτερης τάξης μπορεί να εξαρτάται από τη συγκέντρωση ενός αντιδρώντος δεύτερης τάξης ή δύο αντιδραστηρίων πρώτης τάξης.
Διαφορά μεταξύ Μοριακής και Τάξης Αντίδρασης
Ορισμός
Μοριακότητα: Η μοριακή ικανότητα είναι ο αριθμός των μορίων ή ιόντων που συμμετέχουν στο βήμα καθορισμού του ρυθμού.
Σειρά αντίδρασης: Η σειρά αντίδρασης είναι το άθροισμα των δυνάμεων στις οποίες αυξάνονται οι συγκεντρώσεις των αντιδρώντων στην εξίσωση του νόμου ταχύτητας.
Βήμα καθορισμού ποσοστού
Μοριακότητα: Το βήμα προσδιορισμού του ρυθμού χρησιμοποιείται για να ληφθεί η μοριακότητα.
Σειρά αντίδρασης: Η συνολική αντίδραση χρησιμοποιείται για να ληφθεί η σειρά αντίδρασης.
Τιμή
Μοριακότητα: Η μοριακότητα είναι πάντα ένας ακέραιος αριθμός.
Σειρά αντίδρασης: Η σειρά αντίδρασης μπορεί να είναι μηδέν, ακέραιος αριθμός ή κλάσμα.
Προσδιορισμός
Μοριακότητα: Η μοριακότητα προσδιορίζεται κοιτάζοντας τον μηχανισμό της αντίδρασης.
Σειρά αντίδρασης: Η σειρά αντίδρασης καθορίζεται με πειραματικές μεθόδους.
Συμπέρασμα
Η μοριακότητα και η σειρά αντίδρασης είναι δύο διαφορετικοί όροι που χρησιμοποιούνται για να εξηγήσουν τον ρυθμό μιας χημικής αντίδρασης. Η μοριακή ικανότητα λαμβάνεται από τον μηχανισμό της αντίδρασης. Η σειρά της αντίδρασης προκύπτει από τον νόμο ταχύτητας της αντίδρασης. Η διαφορά μεταξύ της μοριακής και της σειράς αντίδρασης είναι ότι η μοριακότητα είναι μια θεωρητική έννοια, ενώ η σειρά της αντίδρασης προσδιορίζεται πειραματικά.




