Διαφορά μεταξύ των αντιδράσεων προσθήκης και αντικατάστασης
Κύρια διαφορά – Αντιδράσεις προσθήκης έναντι αντικατάστασης
Οι αντιδράσεις προσθήκης, οι αντιδράσεις υποκατάστασης και οι αντιδράσεις εξάλειψης είναι θεμελιώδεις αντιδράσεις στην οργανική χημεία. Οι περισσότερες χημικές συνθέσεις και ταυτοποιήσεις βασίζονται σε αυτές τις αντιδράσεις. Αυτές οι αντιδράσεις μπορεί να συμβούν είτε σε ένα είτε σε δύο στάδια. Η κύρια διαφορά μεταξύ των αντιδράσεων προσθήκης και υποκατάστασης είναι ότι οι αντιδράσεις προσθήκης περιλαμβάνουν τον συνδυασμό δύο ή περισσότερων ατόμων ή λειτουργικών ομάδων ενώ οιαντιδράσεις υποκατάστασης περιλαμβάνουν τη μετατόπιση ενός ατόμου ή μιας λειτουργικής ομάδας από μια άλλη λειτουργική ομάδα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η αντίδραση προσθήκης
– Ορισμός, Ταξινόμηση, Χαρακτηριστικά, Παραδείγματα
2. Τι είναι η αντίδραση υποκατάστασης
– Ορισμός, Ταξινόμηση, Χαρακτηριστικά, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ των αντιδράσεων προσθήκης και αντικατάστασης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αντίδραση προσθήκης, πρόσθετο, κυκλο-προσθήκη, ηλεκτρόφιλο, ηλεκτρόφιλη προσθήκη, ηλεκτρόφιλη υποκατάσταση, προσθήκη ελεύθερων ριζών, ομάδα εξόδου, αντίδραση μη πολικής προσθήκης, πυρηνόφιλο, πυρηνόφιλη προσθήκη, πυρηνόφιλη αντικατάσταση, πολική προσθήκη, , Αντίδραση Υποκατάστασης, Υπόστρωμα
Τι είναι η αντίδραση προσθήκης
Η αντίδραση προσθήκης είναι ο συνδυασμός δύο ή περισσότερων ατόμων ή μορίων προκειμένου να σχηματιστεί ένα μεγάλο μόριο. Αυτό το μεγάλο μόριο είναι γνωστό ως προσαγωγικό . Οι περισσότερες αντιδράσεις προσθήκης περιορίζονται σε μόρια με ακόρεστους δεσμούς που έχουν είτε διπλούς δεσμούς είτε τριπλούς δεσμούς. Αυτές οι αντιδράσεις προσθήκης μπορούν να ταξινομηθούν ως εξής.
Ταξινόμηση της αντίδρασης προσθήκης
- Αντιδράσεις πολικής προσθήκης
- Ηλεκτρόφιλη προσθήκη
- Πυρηνόφιλη προσθήκη
- Αντιδράσεις μη πολικής προσθήκης
- Προσθήκη ελεύθερων ριζών
- Cyclo-Addition
Ηλεκτρόφιλη προσθήκη
Μια ηλεκτρόφιλη προσθήκη είναι ο συνδυασμός ενός ηλεκτρόφιλου με ένα μόριο. Ένα ηλεκτρόφιλο είναι ένα άτομο ή ένα μόριο που μπορεί να δεχτεί ένα ζεύγος ηλεκτρονίων από ένα είδος πλούσιο σε ηλεκτρόνια και να σχηματίσει έναν ομοιοπολικό δεσμό. Για να δεχτούν περισσότερα ηλεκτρόνια, τα ηλεκτρόφιλα είναι θετικά ή ουδέτερα φορτισμένα και έχουν ελεύθερα τροχιακά για τα εισερχόμενα ηλεκτρόνια. Δεν δίνεται υποπροϊόν από αντίδραση προσθήκης.
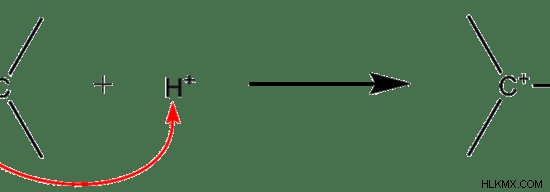
Εικόνα 01:Ηλεκτρόφιλη προσθήκη
Στο παραπάνω παράδειγμα, το H λειτουργεί ως ηλεκτρόφιλο. Είναι θετικά φορτισμένο. Ο δεσμός pi του διπλού δεσμού είναι πλούσιος σε ηλεκτρόνια. Επομένως, το ηλεκτρόφιλο (Η) επιτίθεται στον διπλό δεσμό και λαμβάνει ηλεκτρόνια για να εξουδετερώσει το φορτίο του. Στο παραπάνω παράδειγμα, το νεοσχηματισμένο μόριο είναι και πάλι ηλεκτρόφιλο. Ως εκ τούτου, μπορεί επίσης να υποστεί ηλεκτροφιλικές αντιδράσεις προσθήκης.
Πυρηνόφιλη προσθήκη
Η πυρηνόφιλη προσθήκη είναι ένας συνδυασμός ενός πυρηνόφιλου με ένα μόριο. Ένα πυρηνόφιλο είναι ένα άτομο ή μόριο που μπορεί να δώσει ζεύγη ηλεκτρονίων. Τα πυρηνόφιλα μπορούν να δωρίσουν ηλεκτρόνια στα ηλεκτρόφιλα. Μόρια που έχουν δεσμούς pi, άτομα ή μόρια με ζεύγη ελεύθερων ηλεκτρονίων, δρουν ως πυρηνόφιλα.
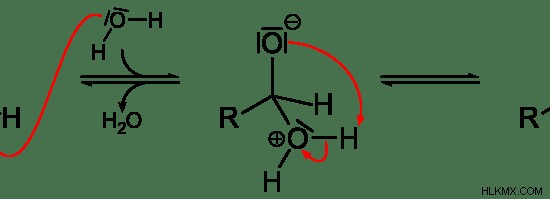
Εικόνα 02:Πυρηνόφιλη προσθήκη
Στην παραπάνω εικόνα, "H2 Το O" είναι ένα πυρηνόφιλο και έχει μεμονωμένα ζεύγη ηλεκτρονίων στο άτομο οξυγόνου. Μπορεί να συνδεθεί με το κεντρικό άτομο άνθρακα, καθώς το άτομο C έχει μερικό θετικό φορτίο λόγω της πολικότητας του δεσμού –C=O.
Προσθήκη ελεύθερων ριζών
Η προσθήκη ελεύθερων ριζών μπορεί να προκύψει μεταξύ δύο ριζών ή μεταξύ ενός ριζικού και ενός μη ριζικού. Ωστόσο, η προσθήκη ελεύθερων ριζών γίνεται μέσω τριών βημάτων:
- Έναρξη – σχηματισμός ριζοσπαστικού
- Διάδοση – η ρίζα αντιδρά με μη ρίζες για να σχηματίσει νέες ρίζες
- Τερματισμός – δύο ρίζες συνδυάζονται και ο σχηματισμός νέων ριζών τερματίζεται
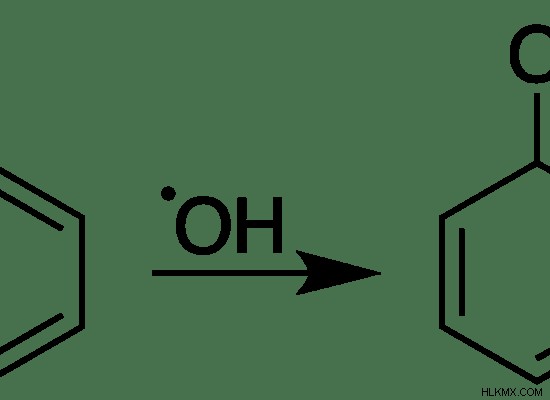
Εικόνα 03:Η αντίδραση της ρίζας «.OH» με το βενζόλιο σχηματίζει μια νέα ρίζα.
Cyclo-Addition
Ο σχηματισμός ενός κυκλικού μορίου από τον συνδυασμό δύο κυκλικών ή μη κυκλικών μορίων είναι γνωστός ως κυκλο-προσθήκη. Η αντίδραση Diels-Alder είναι ένα καλό παράδειγμα για την κυκλική προσθήκη.
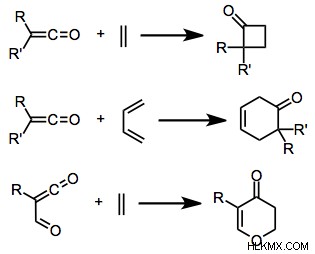
Εικόνα 4:Παράδειγμα Cyclo-Addition
Η παραπάνω εικόνα δείχνει την προσθήκη καρβοξυλικών ενώσεων με αλκένια. Αυτές οι προσθήκες είχαν ως αποτέλεσμα το σχηματισμό μιας κυκλικής ένωσης.
Τι είναι η αντίδραση υποκατάστασης
Η αντίδραση υποκατάστασης είναι μια αντίδραση που περιλαμβάνει την αντικατάσταση ενός ατόμου ή μιας ομάδας ατόμων από ένα άλλο άτομο ή μια ομάδα ατόμων. Αυτό έχει ως αποτέλεσμα ένα υποπροϊόν που ονομάζεται ομάδα αποχώρησης . Η γενική ταξινόμηση των αντιδράσεων υποκατάστασης (ανάλογα με τον τύπο του υποκαταστάτη) είναι η παρακάτω.
- Ηλεκτρόφιλη υποκατάσταση
- Πυρηνόφιλη υποκατάσταση
- Ριζική υποκατάσταση
Ηλεκτρόφιλη υποκατάσταση
Ηλεκτρόφιλη υποκατάσταση είναι η αντικατάσταση ενός ατόμου ή μιας λειτουργικής ομάδας από ένα ηλεκτρόφιλο. Και εδώ, το ηλεκτρόφιλο είναι ένα άτομο ή ένα μόριο που μπορεί να δεχτεί ένα ζεύγος ηλεκτρονίων από ένα είδος πλούσιο σε ηλεκτρόνια και φέρει είτε θετικό φορτίο είτε ουδέτερο φορτίο.

Εικόνα 05:Ηλεκτρόφιλη υποκατάσταση του NO2+ σε βενζόλιο
Στο παραπάνω παράδειγμα, ένα άτομο υδρογόνου του δακτυλίου βενζολίου εκτοπίζεται από το NO2 . Εδώ, ΟΧΙ2 ομάδα δρα ως ηλεκτρόφιλο που είναι θετικά φορτισμένο. Το άτομο υδρογόνου είναι η αποχωρούσα ομάδα.
Πυρηνόφιλη υποκατάσταση
Η πυρηνόφιλη υποκατάσταση είναι η αντικατάσταση ενός ατόμου ή μιας λειτουργικής ομάδας από ένα πυρηνόφιλο. Εδώ επίσης, ένα πυρηνόφιλο είναι ένα άτομο ή μόριο που μπορεί να δώσει ζεύγη ηλεκτρονίων και έχει αρνητικό φορτίο ή είναι ουδέτερα φορτισμένο.
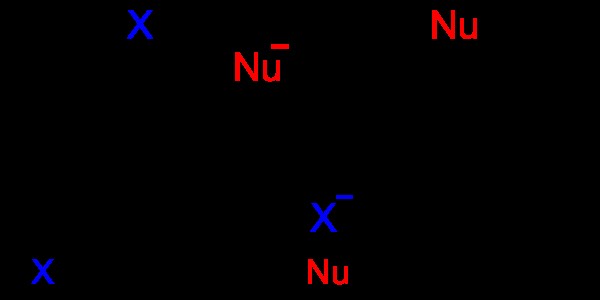
Εικόνα 06:Αρωματική πυρηνόφιλη υποκατάσταση
Στην παραπάνω εικόνα, το "Nu" υποδηλώνει ένα πυρηνόφιλο και αντικαθιστά το άτομο "Χ" του αρωματικού μορίου. Το άτομο "X" είναι η αποχωρούσα ομάδα.
Ριζική υποκατάσταση
Η ριζική υποκατάσταση περιλαμβάνει τις αντιδράσεις των ριζών με τα υποστρώματα. Η ριζική υποκατάσταση περιέχει επίσης τουλάχιστον δύο στάδια (όπως και στην αντίδραση προσθήκης ριζών) για την ολοκλήρωση της αντίδρασης. Τις περισσότερες φορές, εμπλέκονται τρία βήματα.
- Έναρξη- σχηματισμός ριζοσπαστικού
- Διάδοση- η ρίζα αντιδρά με μη ρίζες για να σχηματίσει νέες ρίζες
- Τερματισμός- δύο ρίζες συνδυάζονται και ο σχηματισμός νέων ριζών τερματίζεται
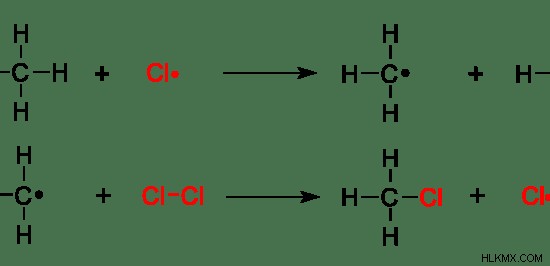
Εικόνα 7:Ριζική υποκατάσταση μεθανίου
Στο παραπάνω παράδειγμα, ένα άτομο υδρογόνου μεθανίου αντικαθίσταται από ρίζες "Cl". Το άτομο υδρογόνου είναι η αποχωρούσα ομάδα.
Διαφορά μεταξύ των αντιδράσεων προσθήκης και αντικατάστασης
Ορισμός
Αντίδραση προσθήκης: Η αντίδραση προσθήκης είναι ο συνδυασμός δύο ή περισσότερων ατόμων ή μορίων προκειμένου να σχηματιστεί ένα μεγάλο μόριο.
Αντίδραση υποκατάστασης: Μια αντίδραση υποκατάστασης είναι μια αντίδραση που περιλαμβάνει την αντικατάσταση ενός ατόμου ή μιας ομάδας ατόμων από ένα άλλο άτομο ή μια ομάδα ατόμων.
Τελικό μόριο
Αντίδραση προσθήκης: Το μεγάλο μόριο που σχηματίζεται μετά την αντίδραση προσθήκης ονομάζεται προϊόν προσθήκης.
Αντίδραση υποκατάστασης: Το τμήμα του μορίου που δεν περιλαμβάνει το ηλεκτρόφιλο ή την αποχωρούσα ομάδα ονομάζεται υπόστρωμα.
Υποπροϊόν
Αντίδραση προσθήκης: Δεν σχηματίζεται υποπροϊόν στις αντιδράσεις προσθήκης.
Αντίδραση υποκατάστασης: Ένα παραπροϊόν σχηματίζεται σε αντιδράσεις υποκατάστασης. Το υποπροϊόν είναι η αποχωρούσα ομάδα.
Μοριακή μάζα του υποστρώματος ή του προσαγωγού
Αντίδραση προσθήκης: Η μοριακή μάζα της αντίδρασης προσθήκης του προϊόντος προσθήκης αυξάνεται πάντα από εκείνη του αρχικού μορίου λόγω του συνδυασμού ενός νέου ατόμου ή μιας ομάδας.
Αντίδραση υποκατάστασης: Η μοριακή μάζα του υποστρώματος στην αντίδραση υποκατάστασης μπορεί είτε να αυξηθεί είτε να μειωθεί από εκείνη του αρχικού μορίου ανάλογα με την υποκατεστημένη ομάδα.
Συμπέρασμα
Οι αντιδράσεις προσθήκης και υποκατάστασης χρησιμοποιούνται για να εξηγήσουν τους μηχανισμούς αντίδρασης στην οργανική χημεία. Η κύρια διαφορά μεταξύ των αντιδράσεων προσθήκης και υποκατάστασης είναι ότι οι αντιδράσεις προσθήκης περιλαμβάνουν τον συνδυασμό δύο ή περισσότερων ατόμων ή λειτουργικών ομάδων ενώ οι αντιδράσεις υποκατάστασης περιλαμβάνουν τη μετατόπιση ενός ατόμου ή μιας λειτουργικής ομάδας από μια άλλη λειτουργική ομάδα.
Εικόνα Ευγενική προσφορά:
1. «Ηλεκτρόφιλος μηχανισμός υδρονίων προσθήκης» Από την Omegakent – Δική εργασία (Δημόσιος Τομέας) μέσω του Commons Wikimedia
2. «Σχηματισμός ένυδρου αλδεΰδης» Από Sponk (ομιλία) – Δική εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia
3. «Αντίδραση υδροξυλίου βενζολίου» Από DMacks (συζήτηση) – Δική εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia
4. "KetGen" By OrganicReactions – Δική εργασία (CC BY 3.0) μέσω Commons Wikimedia
5. "Benzene-nitration-mechanism" By Benjah-bmm27 – Δική του εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia
6. "Αρωματική πυρηνόφιλη υποκατάσταση" Δημόσιος Τομέας) μέσω του Commons Wikimedia
7. "MethaneChlorinationPropagationStep" Από V8rik στην αγγλική Wikipedia (CC BY-SA 3.0) μέσω Commons Wikimedia




