Διαφορά μεταξύ αλκαλίου και αλκαλικού
Κύρια διαφορά – Αλκαλικό vs Αλκαλικό
Τα μέταλλα αλκαλίων και αλκαλικών γαιών είναι βασικά στοιχεία και οι ενώσεις που σχηματίζουν είναι επίσης βασικές ενώσεις. Όταν προστίθενται στο νερό, τα διαλύματα εμφανίζουν τιμές pH υψηλότερες από pH 7. Αυτές οι ενώσεις χρησιμοποιούνται για διαφορετικούς σκοπούς όπως η εξουδετέρωση ή η μείωση της οξύτητας ενός μέσου. Τα αλκαλικά μέταλλα είναι τα μέταλλα της ομάδας 1 του περιοδικού πίνακα, ενώ τα μέταλλα των αλκαλικών γαιών ανήκουν στην ομάδα 2. Η κύρια διαφορά μεταξύ αλκαλίων και αλκαλικών είναι ότι τα μέταλλα αλκαλίων έχουν ένα ηλεκτρόνιο σθένους ενώ τα μέταλλα αλκαλικών γαιών έχουν δύο ηλεκτρόνια σθένους. δυνατός>
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Αλκάλι
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι αλκαλικό
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ αλκαλίου και αλκαλικού
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ αλκαλίου και αλκαλικού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αλκάλια, μέταλλα αλκαλίων, αλκαλικά, μέταλλα αλκαλικών γαιών, περιοδικός πίνακας, pH, ηλεκτρόνια σθένους
Τι είναι το Αλκάλι
Ο όρος αλκάλιο χρησιμοποιείται για την ονομασία των στοιχείων της ομάδας 1 του περιοδικού πίνακα (λίθιο, νάτριο, κάλιο κ.λπ.). Αυτά τα στοιχεία είναι γνωστά ως μέταλλα αλκαλίων. Οι βασικές ενώσεις που σχηματίζονται από αυτά τα στοιχεία είναι αλκαλικές ενώσεις. Μια αλκαλική ένωση είναι μια ουσία που μπορεί να σχηματίσει ιόντα ΟΗ όταν προστεθεί στο νερό. Επομένως, οι αλκαλικές ενώσεις διαλύονται στο νερό για να δώσουν διαλύματα με τιμές υψηλότερες από pH 7. Όλα τα αλκάλια έχουν τιμές pH μεγαλύτερες από 7. Αυτές είναι βασικές ενώσεις.
Οι αλκαλικές ουσίες μπορούν να μετατρέψουν το χρώμα της κόκκινης λακκούβας σε μπλε χρώμα. Μπορούν επίσης να αντιδράσουν με όξινες ενώσεις δίνοντας ένα αλάτι και νερό ως τελικά προϊόντα. Ως εκ τούτου, αλκαλικές ουσίες μπορούν να χρησιμοποιηθούν για την εξουδετέρωση ενός όξινου διαλύματος. Τα αλκαλικά μέταλλα είναι πολύ μαλακά (μπορούμε να κόψουμε εύκολα το νάτριο χρησιμοποιώντας ένα μαχαίρι). Αυτά τα στοιχεία έχουν ένα ηλεκτρόνιο σθένους στο εξώτατο τροχιακό. Ως εκ τούτου, είναι πολύ αντιδραστικά στοιχεία. Μπορούν να σχηματίσουν κατιόντα +1 αφαιρώντας το ηλεκτρόνιο σθένους.
Στη συμπυκνωμένη μορφή αλκαλίων, είναι διαβρωτικά και μπορεί να προκαλέσουν ερεθισμούς στο δέρμα. Τα πιο κοινά αλκάλια περιλαμβάνουν υδροξείδια και ανθρακικά. Η αντίδραση μεταξύ ενός οξέος και ενός υδροξειδίου θα δώσει ένα αλάτι και νερό. Η αντίδραση μεταξύ ενός οξέος και ενός ανθρακικού άλατος δίνει ένα αλάτι, νερό και αέριο διοξείδιο του άνθρακα.

Εικόνα 1:Υδροξείδιο του νατρίου
Παραδείγματα
- Υδροξείδιο του νατρίου (NaOH)
- Υδροξείδιο του καλίου (KOH)
- Οξείδιο λιθίου (Li2 O)
- Αμμωνία (NH3 )
Τι είναι αλκαλικό
Ο όρος Αλκαλικό χρησιμοποιείται για την ονομασία στοιχείων της ομάδας 2 του περιοδικού πίνακα (μαγνήσιο, ασβέστιο, στρόντιο κ.λπ.). Αυτά είναι γνωστά ως μέταλλα αλκαλικών γαιών. Αυτές οι ενώσεις σχηματίζουν επίσης ιόντα ΟΗ όταν προστίθενται στο νερό. Τα διαλύματα των αλκαλικών ενώσεων έχουν υψηλότερες τιμές pH (>7).
Αυτές οι αλκαλικές ενώσεις μπορούν επίσης να μετατρέψουν το κόκκινο χρώμα σε μπλε. Έχουν βασικές ιδιότητες. Τα μέταλλα των αλκαλικών γαιών είναι σκληρότερα από τα αλκαλικά μέταλλα. Αυτά τα στοιχεία σχηματίζουν κατιόντα +2 επειδή έχουν δύο ηλεκτρόνια σθένους και ένα κατιόν μπορεί να σχηματιστεί αφαιρώντας αυτά τα ηλεκτρόνια. Ωστόσο, δεδομένου ότι αυτά τα ηλεκτρόνια βρίσκονται στο τροχιακό s ως ζεύγος ηλεκτρονίων, αυτά τα στοιχεία δεν είναι τόσο αντιδραστικά.
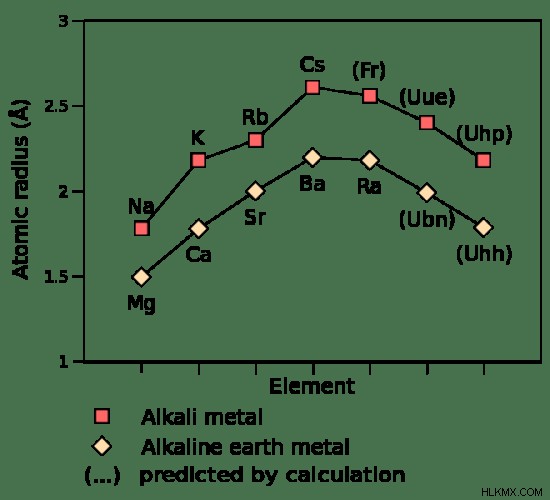
Εικόνα 2:Σύγκριση ατομικών ακτίνων αλκαλικών και αλκαλικών γαιών μετάλλων
Τα μέταλλα των αλκαλικών γαιών έχουν μικρότερη ατομική ακτίνα από τα αλκαλικά μέταλλα. Αυτό συμβαίνει επειδή ο αριθμός των ηλεκτρονίων και των πρωτονίων είναι μεγαλύτερος από τα γειτονικά στοιχεία της ομάδας 1.
Similarities Between Alkali and Alkaline">Similarities Between Alkali and Alkaline
- Και τα δύο έχουν βασικές ιδιότητες.
- Και τα δύο μπορούν να μετατρέψουν την κόκκινη λακκούβα σε μπλε χρώμα.
- Και οι δύο τύποι ενώσεων μπορούν να σχηματίσουν υδατικά διαλύματα με>7 pH.
- Και τα δύο μπορούν να σχηματίσουν ιόντα ΟΗ όταν προστεθούν στο νερό.
Διαφορά μεταξύ αλκαλίου και αλκαλικού
Ορισμός
Αλκάλι :Ο όρος Αλκάλι χρησιμοποιείται για να ονομάσει τα στοιχεία της ομάδας 1 του περιοδικού πίνακα.
Αλκαλικό: Ο όρος Αλκαλικό χρησιμοποιείται για να ονομάσει στοιχεία της ομάδας 2 του περιοδικού πίνακα.
Φυσικές ιδιότητες
Αλκάλι :Τα αλκαλικά μέταλλα είναι μαλακά.
Αλκαλικό: Τα μέταλλα των αλκαλικών γαιών είναι σκληρά.
Ηλεκτρόνια σθένους
Αλκάλι :Τα αλκαλικά στοιχεία έχουν ένα ηλεκτρόνιο σθένους.
Αλκαλικό: Τα μέταλλα των αλκαλικών γαιών έχουν δύο ηλεκτρόνια σθένους.
Κατιόντα
Αλκάλι :Τα αλκαλικά μέταλλα σχηματίζουν +1 κατιόντα.
Αλκαλικό: Τα μέταλλα των αλκαλικών γαιών σχηματίζουν +2 κατιόντα.
Ενέργεια ιονισμού
Αλκάλι :Τα αλκαλικά μέταλλα έχουν χαμηλότερη ενέργεια ιονισμού.
Αλκαλικό: Τα μέταλλα των αλκαλικών γαιών έχουν υψηλότερη ενέργεια ιονισμού.
Συμπέρασμα
Τα αλκαλιμέταλλα είναι τα στοιχεία της ομάδας 1 του περιοδικού πίνακα. Τα μέταλλα των αλκαλικών γαιών είναι τα στοιχεία της ομάδας 2. Και τα δύο έχουν βασικές ιδιότητες. Όταν προστεθούν στο νερό, και τα δύο μπορούν να σχηματίσουν διαλύματα με υψηλότερες τιμές pH (>pH). Η κύρια διαφορά μεταξύ αλκαλίου και αλκαλίου είναι ότι τα αλκαλικά μέταλλα έχουν ένα ηλεκτρόνιο σθένους ενώ τα μέταλλα αλκαλικών γαιών έχουν δύο ηλεκτρόνια σθένους.




