Διαφορά μεταξύ ομοιοπολικού και πολικού ομοιοπολικού
Κύρια διαφορά – Ομοιοπολικό εναντίον πολικό ομοιοπολικό
Υπάρχουν διαφορετικοί τύποι χημικών δεσμών στις ενώσεις. Οι ομοιοπολικοί δεσμοί είναι τέτοιοι χημικοί δεσμοί. Ένας ομοιοπολικός δεσμός σχηματίζεται όταν δύο άτομα μοιράζονται τα ασύζευκτα ηλεκτρόνια τους μεταξύ τους. Η διατήρηση μη ζευγαρωμένων ηλεκτρονίων δεν είναι σταθερή κατάσταση για ένα άτομο. Ως εκ τούτου, σχηματίζουν ομοιοπολικούς δεσμούς προκειμένου να υπακούουν στη διαμόρφωση των ηλεκτρονίων γύρω από το άτομο. Οι ομοιοπολικοί δεσμοί μπορεί να είναι είτε πολικοί είτε μη πολικοί. Η κύρια διαφορά μεταξύ ομοιοπολικού και πολικού ομοιοπολικού είναι ότι ένας ομοιοπολικός δεσμός μπορεί να είναι είτε πολικός είτε μη πολικός, ενώ ένας πολικός ομοιοπολικός δεσμός είναι ουσιαστικά πολικός.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Covalent
– Ορισμός, κανόνας οκτάδας, διαφορετικοί τύποι
2. Τι είναι το Polar Covalent
– Ορισμός, Ηλεκτραρνητικότητα
3. Ποια είναι η διαφορά μεταξύ ομοιοπολικού και πολικού ομοιοπολικού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:χημικός δεσμός, ομοιοπολικός δεσμός, ομοιοπολική ένωση, ηλεκτραρνητικότητα, μη πολικός, κανόνας οκτάδας, δεσμός Pi, πολικός ομοιοπολικός δεσμός, δεσμός σίγμα

Τι είναι το Covalent
Ο όρος ομοιοπολικός χρησιμοποιείται για την ονομασία χημικών δεσμών που σχηματίζονται από την κοινή χρήση μη ζευγαρωμένων ηλεκτρονίων μεταξύ των ατόμων ή για την ονομασία ενώσεων που αποτελούνται από άτομα συνδεδεμένα μεταξύ τους μέσω ομοιοπολικών δεσμών. Οι ομοιοπολικοί δεσμοί σχηματίζονται όταν δύο άτομα μοιράζονται τα μη ζευγαρωμένα ηλεκτρόνια τους μεταξύ τους προκειμένου να αποκτήσουν μια σταθερή διαμόρφωση ηλεκτρονίων.
Σύμφωνα με τον κανόνα της οκτάδας της ηλεκτρονικής διαμόρφωσης, ένα άτομο διαφορετικό από το υδρογόνο τείνει να σχηματίζει δεσμούς έως ότου περιβάλλεται από οκτώ ηλεκτρόνια σθένους. Ως εκ τούτου, τα άτομα σχηματίζουν είτε ιοντικούς δεσμούς είτε ομοιοπολικούς δεσμούς προκειμένου να υπακούουν στον κανόνα της οκτάδας.
Όταν σχηματίζεται ένας ομοιοπολικός δεσμός, τα δύο ηλεκτρόνια μοιράζονται και τα δύο άτομα. Για παράδειγμα, ένα άτομο άνθρακα στη θεμελιώδη κατάσταση έχει τέσσερα ηλεκτρόνια σθένους (Τα ηλεκτρόνια σθένους είναι ηλεκτρόνια που βρίσκονται στο εξώτατο τροχιακό ενός ατόμου). Προκειμένου να ολοκληρωθεί η διαμόρφωση ηλεκτρονίων, το άτομο άνθρακα μοιράζεται τα τέσσερα ηλεκτρόνια του με άλλα τέσσερα ηλεκτρόνια (ασύζευκτα). Το απλούστερο παράδειγμα είναι το μεθάνιο. Στο μεθάνιο, τέσσερα άτομα υδρογόνου μοιράζονται τα μη ζευγαρωμένα ηλεκτρόνια τους με ένα άτομο άνθρακα, σχηματίζοντας τέσσερις ομοιοπολικούς δεσμούς.
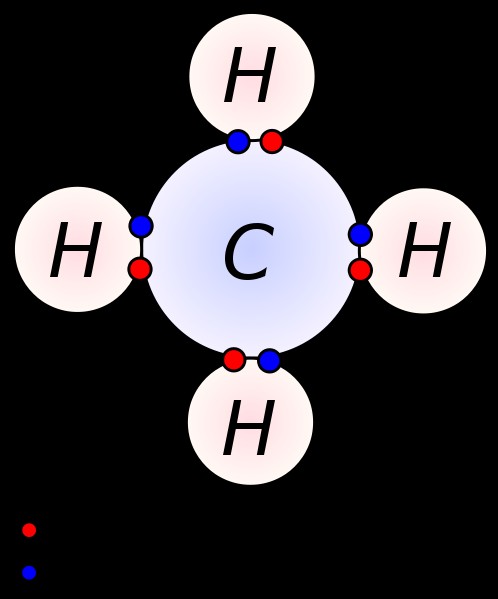
Εικόνα 1:Τέσσερις ομοιοπολικοί δεσμοί στο μόριο μεθανίου
Μια ομοιοπολική ένωση είναι μια χημική ένωση που αποτελείται από άτομα συνδεδεμένα μεταξύ τους μέσω ομοιοπολικών δεσμών. Αυτές οι ενώσεις μπορεί να είναι μόρια ή ιόντα. Ένας ομοιοπολικός δεσμός μπορεί να είναι είτε πολικός είτε μη πολικός. Οι ομοιοπολικοί δεσμοί μπορεί επίσης να είναι απλοί δεσμοί, διπλοί δεσμοί ή τριπλοί δεσμοί. Ένας μεμονωμένος δεσμός είναι δεσμός σίγμα. Οι διπλοί και τριπλοί δεσμοί αποτελούνται από δεσμούς pi μαζί με δεσμό σίγμα.
Τι είναι το Polar Covalent
Ο όρος πολικός ομοιοπολικός χρησιμοποιείται για να ονομάσει έναν ομοιοπολικό δεσμό που είναι πολικός. Υπάρχουν δύο τύποι ομοιοπολικών δεσμών ως πολικοί ομοιοπολικοί δεσμοί και μη πολικοί ομοιοπολικοί δεσμοί. Οι μη πολικοί ομοιοπολικοί δεσμοί σχηματίζονται όταν δύο άτομα μοιράζονται ίσα ζεύγη ηλεκτρονίων. Ένας πολικός ομοιοπολικός δεσμός σχηματίζεται όταν δύο άτομα μοιράζονται άνιση κατανομή ηλεκτρονίων.
Η άνιση κατανομή ηλεκτρονίων προκαλεί στον ομοιοπολικό δεσμό έναν ελαφρύ διαχωρισμό ηλεκτρικού φορτίου. Τότε το ένα άκρο του ομοιοπολικού δεσμού έχει δέλτα θετικό ηλεκτρικό φορτίο και το άλλο άκρο θα έχει δέλτα αρνητικό φορτίο. Αυτό είναι γνωστό ως διπολική στιγμή.
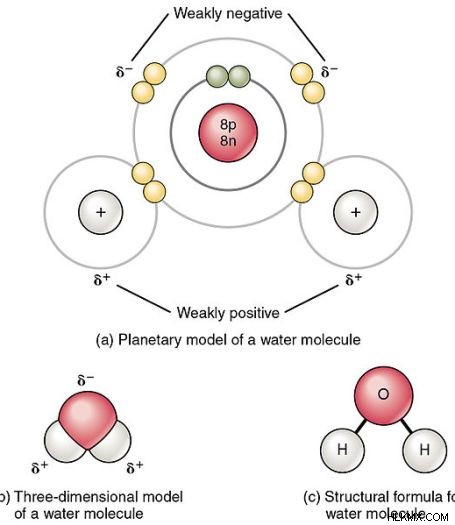
Εικόνα 2:Πολικοί ομοιοπολικοί δεσμοί στο μόριο του νερού
Ο λόγος για αυτήν την άνιση κατανομή ηλεκτρονίων μεταξύ δύο ατόμων είναι η διαφορά μεταξύ των τιμών ηλεκτραρνητικότητας των ατόμων. Όταν δύο άτομα με διαφορετική ηλεκτραρνητικότητα βρίσκονται σε ομοιοπολικό δεσμό, τα ηλεκτρόνια του δεσμού έλκονται περισσότερο προς το πιο ηλεκτραρνητικό άτομο από το άλλο άτομο. Για παράδειγμα, ένας ομοιοπολικός δεσμός μεταξύ C και O θα δείξει ένα θετικό φορτίο δέλτα στο άτομο άνθρακα και ένα αρνητικό φορτίο δέλτα στο άτομο οξυγόνου. Αυτό συμβαίνει επειδή η ηλεκτραρνητικότητα του Ο είναι 3,44 και για τον άνθρακα, είναι 2,55.
Διαφορά μεταξύ ομοιοπολικού και πολικού ομοιοπολικού
Ορισμός
Ομοιοπολικό: Ο όρος ομοιοπολικός αναφέρεται σε χημικούς δεσμούς που σχηματίζονται από την κοινή χρήση μη ζευγαρωμένων ηλεκτρονίων μεταξύ ατόμων ή σε ενώσεις που αποτελούνται από άτομα συνδεδεμένα μεταξύ τους μέσω ομοιοπολικών δεσμών.
Πολικό ομοιοπολικό: Ο όρος πολικός ομοιοπολικός χρησιμοποιείται για να ονομάσει έναν ομοιοπολικό δεσμό που είναι πολικός.
Πολικότητα
Ομοιοπολικό: Οι ομοιοπολικοί δεσμοί μπορεί να είναι είτε πολικοί είτε μη πολικοί.
Πολικό ομοιοπολικό: Οι πολικοί ομοιοπολικοί δεσμοί είναι πολικοί.
Διαχωρισμός ηλεκτρικού φορτίου
Ομοιοπολικό: Οι ομοιοπολικοί δεσμοί μπορεί να έχουν ή να μην έχουν ηλεκτρονικό διαχωρισμό φορτίου.
Πολικό ομοιοπολικό: Οι πολικοί ομοιοπολικοί δεσμοί δείχνουν έναν ελαφρύ διαχωρισμό ηλεκτρικού φορτίου.
Διπολική στιγμή
Ομοιοπολικό: Το ομοιοπολικό μπορεί να εμφανίζει διπολική ροπή ή όχι.
Πολικό ομοιοπολικό: Οι πολικοί ομοιοπολικοί δεσμοί δείχνουν μια διπολική ροπή.
Συμπέρασμα
Σχηματίζεται ομοιοπολικός δεσμός όταν δύο άτομα μοιράζονται τα μη ζευγαρωμένα ηλεκτρόνια τους μεταξύ τους. Οι ομοιοπολικοί δεσμοί μπορεί να είναι είτε πολικοί είτε μη πολικοί. Η κύρια διαφορά μεταξύ ομοιοπολικού και πολικού ομοιοπολικού είναι ότι ένας ομοιοπολικός δεσμός μπορεί να είναι είτε πολικός είτε μη πολικός, ενώ ένας πολικός ομοιοπολικός δεσμός είναι ουσιαστικά πολικός.




