Διαφορά μεταξύ του Διπόλου του Διπόλου και των Δυνάμεων Διασποράς του Λονδίνου
Κύρια διαφορά – Dipole Dipole vs London Dispersion Forces
Υπάρχουν δύο τύποι δυνάμεων μεταξύ μορίων και ατόμων:πρωτογενείς δεσμοί και δευτερεύοντες δεσμοί. Οι πρωτογενείς δεσμοί είναι οι χημικοί δεσμοί που εμφανίζονται μεταξύ των ατόμων και μπορούν να κατηγοριοποιηθούν ως ιοντικοί, ομοιοπολικοί και μεταλλικοί δεσμοί. Αυτοί οι δεσμοί ονομάζονται και ενδομοριακοί δεσμοί. Οι δευτερεύουσες δυνάμεις είναι ελκτικές δυνάμεις που εμφανίζονται μεταξύ των μορίων. Έτσι, ονομάζονται διαμοριακές δυνάμεις. Υπάρχουν τρεις κύριοι τύποι δευτερογενών δεσμών:δίπολο-δίπολο, διασπορά Λονδίνου και δεσμοί υδρογόνου. Ο δεσμός υδρογόνου είναι ένας ειδικός τύπος έλξης διπόλου-διπόλου που συμβαίνει μεταξύ ενός μοναχικού ζεύγους ηλεκτρονίων σε ένα ηλεκτραρνητικό άτομο και ενός ατόμου υδρογόνου σε έναν πολικό δεσμό. Η κύρια διαφορά μεταξύ των δυνάμεων διασποράς διπόλου-διπόλου και του Λονδίνου είναι ότι δυνάμεις διπόλου-διπόλου εμφανίζονται μεταξύ μορίων με διπολική ροπή, ενώ οι διασπορές του Λονδίνου συμβαίνουν λόγω στιγμιαίων διπόλων που σχηματίζονται σε άτομα ή μη πολικά μόρια.
Αυτό το άρθρο εξηγεί,
1. Τι είναι οι Δίπολες Δυνάμεις;
– Ορισμός, Χαρακτηριστικά, Χαρακτηριστικά, Παραδείγματα
2. Τι είναι οι δυνάμεις διασποράς του Λονδίνου;
– Ορισμός, Χαρακτηριστικά, Χαρακτηριστικά, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Dipole Dipole και London Dispersion Forces;

Τι είναι οι δυνάμεις διπόλου-διπόλου
Δυνάμεις διπόλου-διπόλου εμφανίζονται όταν υπάρχει άνιση κατανομή ηλεκτρονίων μεταξύ δύο ατόμων. Η άνιση κατανομή των ηλεκτρονίων έχει ως αποτέλεσμα αντίθετα φορτία στο μητρικό άτομο, σχηματίζοντας μόνιμα δίπολα. Αυτά τα δίπολα έλκονται μεταξύ τους και σχηματίζουν δυνάμεις διπόλου-διπόλου. Τα μόρια με διπολικές ροπές είναι γνωστά ως πολικά μόρια. Η ισχύς μιας διπολικής ροπής ενός μορίου είναι ανάλογη με την ισχύ μιας δύναμης διπόλου-διπόλου. Ο δεσμός υδρογόνου είναι ένας ειδικός τύπος δύναμης διπόλου-διπόλου. Οι δυνάμεις διπόλου-διπόλου μπορούν να φανούν μεταξύ μορίων όπως το νερό, το HCl κ.λπ. Αυτές οι δυνάμεις δεν εμφανίζονται σε μόρια με κίνηση μηδενικού διπόλου.

Αλληλεπίδραση διπόλου-διπόλου σε HCl
Τι είναι οι δυνάμεις διασποράς του Λονδίνου
Οι δυνάμεις διασποράς του Λονδίνου συμβαίνουν όταν ένας θετικά φορτισμένος πυρήνας ενός ατόμου έλκει το νέφος ηλεκτρονίων ενός άλλου ατόμου. Όταν τα νέφη ηλεκτρονίων και των δύο ατόμων ενώνονται λόγω του ίδιου φορτίου, τα νέφη ηλεκτρονίων απωθούν αμοιβαία το ένα το άλλο. Λόγω της εγγύτητας των νεφών ηλεκτρονίων, σχηματίζονται προσωρινά δίπολα γνωστά ως στιγμιαία δίπολα. Αυτά τα δίπολα εμφανίζονται λόγω της ασύμμετρης κίνησης του ηλεκτρονίου γύρω από τους πυρήνες των ατόμων. Οι δυνάμεις διασποράς του Λονδίνου μπορούν να εμφανιστούν τόσο μεταξύ πολικών όσο και μη πολικών μορίων, μεταξύ ιόντων και μεταξύ των μεμονωμένων ατόμων ευγενών αερίων. Η επίδραση των δυνάμεων διασποράς του Λονδίνου αγνοείται σε μέταλλα, ενώσεις με ιοντικό δεσμό και σε μεγάλα ομοιοπολικά στερεά. Ωστόσο, αυτές οι δυνάμεις λαμβάνονται σημαντικά υπόψη σε μόρια με δυνάμεις διπόλου-διπόλου. Αυτό οφείλεται στο ότι οι ενέργειες των δεσμών των δυνάμεων διασποράς είναι πολύ υψηλότερες από αυτές των δυνάμεων διπόλου-διπόλου.
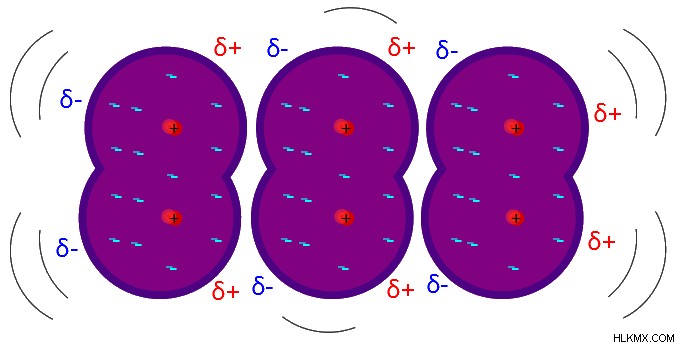
Διαφορά μεταξύ του διπόλου και των δυνάμεων διασποράς του Λονδίνου
Ορισμός
Δυνάμεις διπόλου-διπόλου: Οι δυνάμεις διπόλου-διπόλου είναι ελκτικές δυνάμεις μεταξύ μορίων με μόνιμες κινήσεις διπόλων.
Δυνάμεις διασποράς του Λονδίνου: Οι δυνάμεις διασποράς του Λονδίνου είναι ελκτικές δυνάμεις μεταξύ όλων των ειδών μορίων, συμπεριλαμβανομένων των πολικών, μη πολικών, ιόντων και ευγενών αερίων.
Σχηματισμός
Δυνάμεις διπόλου-διπόλου: Οι δυνάμεις διπόλου-διπόλου εμφανίζονται όταν υπάρχει άνιση κατανομή ηλεκτρονίων μεταξύ δύο ατόμων.
δυνάμεις διασποράς του Λονδίνου: Οι δυνάμεις διασποράς του Λονδίνου συμβαίνουν όταν ένας θετικά φορτισμένος πυρήνας ενός ατόμου έλκει το νέφος ηλεκτρονίων ενός άλλου ατόμου.
Δύναμη δεσμού
Δυνάμεις διπόλου-διπόλου: Οι δυνάμεις διπόλου-διπόλου έχουν ασθενέστερη αντοχή δεσμού.
Δυνάμεις διασποράς του Λονδίνου: Οι δυνάμεις διασποράς του Λονδίνου έχουν υψηλότερη αντοχή δεσμού.
Διπολική στιγμή
Δυνάμεις διπόλου-διπόλου: Πρέπει να υπάρχουν μόνιμα δίπολα.
Δυνάμεις διασποράς του Λονδίνου: Πρέπει να υπάρχουν στιγμιαία δίπολα.
Παραπομπές:
Clugston, M. J. και Rosalind Flemming. Προχωρημένη χημεία . Oxford:Oxford U Press, 2000. Εκτύπωση. Garg, S. K. Ολοκληρωμένη τεχνολογία εργαστηρίου:διαδικασίες παραγωγής . New Delhi:Laxmi Publications, 2005. Print.Mikulecky, Peter, Michelle Rose Gilman, and Kate Brutlag. AP χημεία για ανδρείκελα . Hoboken, NJ:Wiley Publishing, Inc., 2009. Εκτύπωση. Ευγενική προσφορά εικόνας:“Forze di London” Του Riccardo Rovinetti – Δικό έργο (CC BY-SA 3.0) μέσω Commons Wikimedia "Dipole-dipole-interaction-in-HCl-2D" By Benjah-bmm27 – Ίδιο έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia