Διαφορά μεταξύ αζώτου και νιτρικών αλάτων
Κύρια διαφορά – Άζωτο έναντι Νιτρικών
Το άζωτο είναι ένα χημικό στοιχείο στην ομάδα 15 του περιοδικού πίνακα. Μπορεί να σχηματίσει διαφορετικούς τύπους μορίων και ιόντων συνδυάζοντας με διαφορετικά άλλα στοιχεία όπως υδρογόνο, οξυγόνο, άνθρακας κ.λπ. Το νιτρικό είναι ένα τέτοιο ιόν στο οποίο ένα άτομο αζώτου συνδέεται με τρία άτομα οξυγόνου σχηματίζοντας ένα ανιόν. Τα νιτρικά ιόντα μπορούν να σχηματίσουν διαφορετικές ενώσεις αλάτων συνδυάζοντας με διαφορετικά κατιόντα και ομοιοπολικές ενώσεις όπως εστέρες νιτρικού οξέος. Η κύρια διαφορά μεταξύ του αζώτου και του νιτρικού είναι ότι το άζωτο είναι ένα χημικό στοιχείο ενώ το νιτρικό είναι ένα ανιόν.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το άζωτο
– Ορισμός, Χημικές ιδιότητες
2. Τι είναι το Νιτρικόι
– Ορισμός, ενώσεις νιτρικών
3. Ποια είναι η διαφορά μεταξύ αζώτου και νιτρικούι
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αμίδια, αμίνες, ανιόν, κατιόν, ομοιοπολικό, νιτρικό, άζωτο, κύκλος αζώτου, οξυγόνο, σχετική ατομική μάζα, συντονισμός

Τι είναι το άζωτο
Το άζωτο είναι ένα χημικό στοιχείο στην ομάδα 15 του περιοδικού πίνακα και έχει το χημικό σύμβολο "N". Το άζωτο είναι ένα στοιχείο μπλοκ p σύμφωνα με τη διαμόρφωση ηλεκτρονίων του. [Αυτός] 2s2p. Ο ατομικός αριθμός του αζώτου είναι 7 και η σχετική ατομική μάζα είναι περίπου 14 amu. Σε θερμοκρασία δωματίου και τυπική πίεση, το άζωτο υπάρχει ως διατομική αέρια ένωση που είναι άχρωμη, άοσμη και άγευστη.
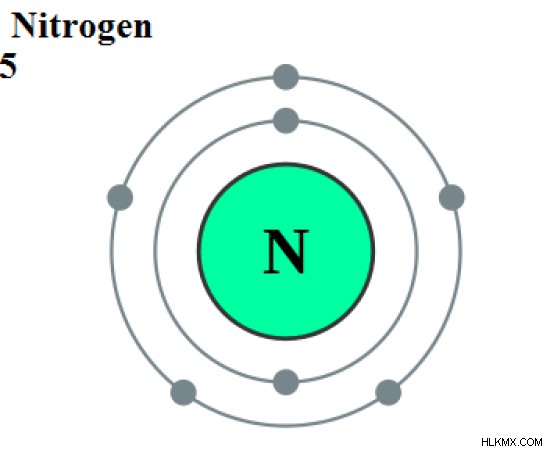
Εικόνα 1:Ατομική δομή του αζώτου
Το άζωτο έχει τρία ασύζευκτα ηλεκτρόνια. Τείνει να σχηματίζει τρεις ομοιοπολικούς δεσμούς για να ολοκληρώσει τα ηλεκτρονιακά κελύφη. Το άζωτο υπάρχει ως N2 αέριο στην ατμόσφαιρα. Είναι μια διατομική ομοιοπολική ένωση. Υπάρχει ένας τριπλός δεσμός μεταξύ των δύο ατόμων αζώτου.
Το άζωτο έχει δύο σταθερά ισότοπα:N-14 και N-15. Αλλά το N-14 είναι το πιο σταθερό και πιο άφθονο ισότοπο. Η αφθονία αυτού του ισοτόπου είναι περίπου 99%. Το άζωτο σχηματίζει ένα ευρύ φάσμα διαφορετικών ενώσεων. Μερικά παραδείγματα περιλαμβάνουν αμίδια, αμίνες, νιτρικά, νιτρίδια, αζίδια, οξείδια, κυανιούχα κ.λπ.
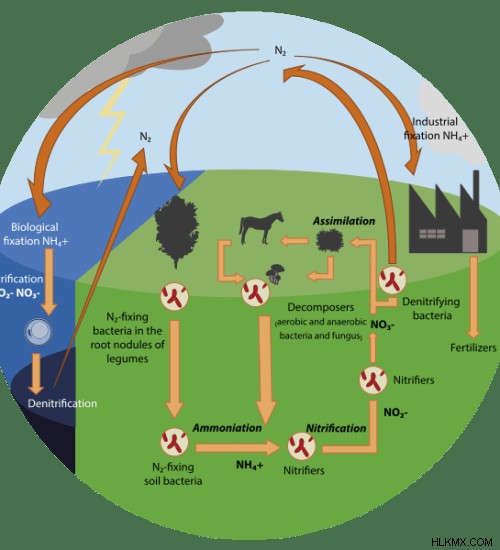
Εικόνα 2:Κύκλος αζώτου
Ο κύκλος του αζώτου δείχνει την κυκλοφορία του αζώτου στο περιβάλλον. Το άζωτο είναι απαραίτητο στοιχείο για τη ζωή στη γη. Περιλαμβάνεται στη χημική σύνθεση πολλών σημαντικών βιολογικών μορίων όπως νουκλεϊκά οξέα, πρωτεΐνες κ.λπ. Επομένως, το άζωτο εμφανίζεται στην ατμόσφαιρα, στο εσωτερικό των οργανισμών, στο έδαφος και κυκλοφορεί ανάμεσά τους.
Τι είναι το νιτρικό άλας
Το νιτρικό είναι ένα ανιόν με τον χημικό τύπο ΟΧΙ3 . Η μοριακή μάζα αυτού του ιόντος είναι 62 g/mol. Είναι μια ομοιοπολική ένωση. Στη δομή Lewis, υπάρχουν δύο άτομα οξυγόνου συνδεδεμένα με το άτομο αζώτου με απλούς δεσμούς και το άλλο άτομο οξυγόνου με διπλό δεσμό. Επομένως, το νιτρικό ιόν έχει δομές συντονισμού. Αλλά η πραγματική δομή αυτού του ιόντος είναι μια υβριδική δομή όλων των δομών συντονισμού. Η γεωμετρία της ένωσης είναι τριγωνική επίπεδη.
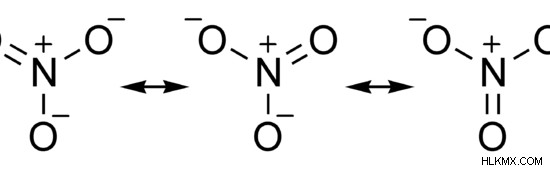
Εικόνα 2:Δομές συντονισμού νιτρικών ιόντων
Όταν το νιτρικό ιόν συνδέεται με ένα πρωτόνιο, ονομάζεται νιτρικό οξύ. Το νιτρικό οξύ είναι ένα βασικό συστατικό για τις περισσότερες αντιδράσεις σύνθεσης στην οργανική χημεία. Για παράδειγμα, το νιτροβενζόλιο συντίθεται με την αντίδραση του βενζολίου με ένα μείγμα νιτρικού οξέος, θειικού οξέος και νερού.
Το νιτρικό ιόν μπορεί να βρεθεί σε ιοντικές ενώσεις ως άλατα και ως ελεύθερο υδατικό ιόν. Τα νιτρικά άλατα είναι κοινά στη γη ως κοιτάσματα ορυκτών. Μερικά παραδείγματα περιλαμβάνουν νιτρικό αμμώνιο, νιτρικό νάτριο, νιτρικό κάλιο, κ.λπ. Τα νιτρικά άλατα είναι ιοντικές ενώσεις που αποτελούνται από νιτρικό ιόν συνδεδεμένο με ένα κατιόν. Οι ομοιοπολικές ενώσεις νιτρικών περιλαμβάνουν εστέρες νιτρικού οξέος.
Στον κύκλο του αζώτου, τα νιτροποιητικά βακτήρια (Nitrobacter ) μετατρέπει τα νιτρώδη ιόντα σε νιτρικά ιόντα. Αλλά απονιτροποιητικά βακτήρια (όπως Ψευδομονάδα ) μπορεί να μετατρέψει το νιτρικό άλας σε αέριο άζωτο.
Διαφορά μεταξύ αζώτου και νιτρικού άλατος
Ορισμός
Άζωτο: Το άζωτο είναι ένα χημικό στοιχείο στην ομάδα 15 του περιοδικού πίνακα και έχει το χημικό σύμβολο "N."
Νιτρικά: Το νιτρικό είναι ένα ανιόν που έχει τον χημικό τύπο NO3 .
Φύση
Άζωτο: Το άζωτο είναι ένα χημικό στοιχείο.
Νιτρικά: Το νιτρικό είναι ένα ανιόν.
Ηλεκτρική φόρτιση
Άζωτο: Ένα άτομο αζώτου δεν έχει καθαρό ηλεκτρικό φορτίο.
Νιτρικά: Το νιτρικό ιόν έχει -1 φόρτιση.
Κύκλος αζώτου
Άζωτο: Το στοιχείο αζώτου κυκλοφορεί στον κύκλο του αζώτου με διάφορες μορφές, όπως αμμωνία, νιτρώδη και νιτρικά.
Νιτρικά: Τα νιτροποιητικά βακτήρια στον κύκλο του αζώτου μετατρέπουν το ιόν αμμωνίου σε νιτρικό ιόν ενώ τα απονιτροποιητικά βακτήρια μετατρέπουν το νιτρικό ιόν σε αέριο άζωτο.
Ενώσεις
Άζωτο: Το άζωτο σχηματίζει ένα ευρύ φάσμα διαφορετικών ενώσεων, συμπεριλαμβανομένων ανόργανων ενώσεων και οργανικών ενώσεων.
Νιτρικά: Το νιτρικό ιόν μπορεί να βρεθεί σε άλατα και σε ομοιοπολικές ενώσεις.
Συμπέρασμα
Το άζωτο είναι ένα χημικό στοιχείο. Το νιτρικό ιόν είναι ένα ανιόν με -1 ηλεκτρικό φορτίο. Το άζωτο μπορεί να βρεθεί να κυκλοφορεί στον κύκλο του αζώτου σε διαφορετικές μορφές, ενώ το νιτρικό ιόν μπορεί να βρεθεί στα βήματα της νιτροποίησης και της απονιτροποίησης. Η κύρια διαφορά μεταξύ του αζώτου και του νιτρικού είναι ότι το άζωτο είναι ένα χημικό στοιχείο ενώ το νιτρικό είναι ένα ανιόν.




