Διαφορά μεταξύ γλυκονικού καλίου και χλωριούχου καλίου
Κύρια διαφορά – Γλυκονικό κάλιο έναντι χλωριούχου καλίου
Το κάλιο είναι ένα χημικό στοιχείο που υποδεικνύεται με το γράμμα "K". Ήταν το πρώτο μέταλλο που απομονώθηκε με ηλεκτρόλυση. Το κάλιο είναι πολύ αντιδραστικό και μπορεί να αντιδράσει με διάφορα άτομα μη μετάλλου για να σχηματίσει διαφορετικές ενώσεις. Το γλυκονικό κάλιο και το χλωριούχο κάλιο είναι δύο τέτοιες ενώσεις του καλίου. Το γλυκονικό κάλιο είναι ένα σημαντικό συμπλήρωμα καλίου. Η κύρια διαφορά μεταξύ του γλυκονικού καλίου και του χλωριούχου καλίου είναι ότι Το γλυκονικό κάλιο είναι το άλας καλίου της συζυγούς βάσης του γλυκονικού οξέος, ενώ το χλωριούχο κάλιο είναι ένα αλογονίδιο μετάλλου του καλίου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το γλυκονικό κάλιο
– Ορισμός, χημική δομή και ιδιότητες
2. Τι είναι το χλωριούχο κάλιο
– Ορισμός, χημική δομή και ιδιότητες
3. Ποιες είναι οι ομοιότητες μεταξύ του γλυκονικού καλίου και του χλωριούχου καλίου
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ γλυκονικού καλίου και χλωριούχου καλίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:ηλεκτρόλυση, συζυγής βάση, γλυκονικό οξύ, όνομα IUPAC, KCl, κάλιο, χλωριούχο κάλιο, D-γλυκονικό κάλιο, γλυκονικό κάλιο

Τι είναι το Γλυκονικό Κάλιο
Το γλυκονικό κάλιο είναι το άλας καλίου της συζυγούς βάσης του γλυκονικού οξέος. Ονομάζεται επίσης ως άλας καλίου D-γλυκονικού οξέος ή D-γλυκονικό κάλιο Το γλυκονικό κάλιο αποτελείται από 16,69% κάλιο κατά βάρος. Το γλυκονικό οξύ είναι ένα καρβοξυλικό οξύ. Έτσι, το ιόν Κ συνδέεται με το άτομο οξυγόνου της ομάδας υδροξυλίου αντικαθιστώντας το άτομο του υδρογόνου. Αυτή η ένωση υπάρχει στη στερεά φάση. Το σημείο τήξης του γλυκονικού καλίου είναι περίπου 175 C.
Το γλυκονικό κάλιο είναι μια άοσμη ένωση που διατίθεται ως λευκή έως κιτρινωπή κρυσταλλική σκόνη ή κόκκοι. Έχει ελαφρώς αλμυρή γεύση. Είναι διαλυτό στο νερό και είναι σταθερό στον αέρα. Η θερμοκρασία αποθήκευσης του γλυκονικού καλίου είναι θερμοκρασία δωματίου. Ο μοριακός τύπος αυτής της ένωσης είναι C6 H11 KO7 . Η ονομασία IUPAC του γλυκονικού καλίου είναι Potassium (2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhe .
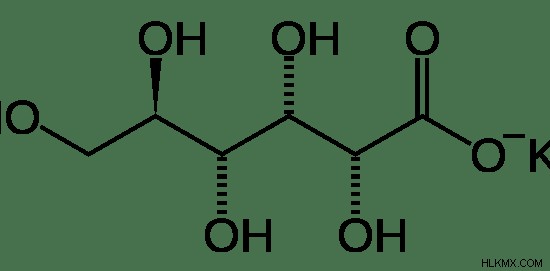
Εικόνα 1:Χημική δομή του γλυκονικού καλίου
Το γλυκονικό κάλιο χρησιμοποιείται ως συμπλήρωμα μετάλλων ή ως δεσμευτικό. Πωλείται ως κάψουλες ή χύμα σκόνη. Σε αυτή την ένωση, το ιόν καλίου (Κ) συνδέεται με τη συζευγμένη βάση του γλυκονικού οξέος μέσω ενός ιοντικού δεσμού. Αυτό σημαίνει ότι υπάρχει ηλεκτροστατική έλξη μεταξύ του Κ και του γλυκονικού ανιόντος.
Τι είναι το χλωριούχο κάλιο
Το χλωριούχο κάλιο είναι ένα αλογονίδιο μετάλλου με τον χημικό τύπο KCl. Είναι μια άοσμη, λευκή κρυσταλλική σκόνη. Διαλύεται εύκολα στο νερό, δημιουργώντας μια γεύση που μοιάζει με αλάτι. Έχει πολλές χρήσεις όπως σε λιπάσματα, εκρηκτικά, επιστημονικές εφαρμογές, επεξεργασία τροφίμων κ.λπ. Το KCl παράγεται από ορυκτά όπως η ποτάσα.
Η μοριακή μάζα του KCl είναι 74,548 g/mol. Τα διαλύματα χλωριούχου καλίου έχουν έντονη αλατούχα γεύση. Το σημείο τήξης του χλωριούχου καλίου είναι 770 C και το σημείο βρασμού είναι 1420 C. Στους 2732 C, οι κρύσταλλοι KCl υψώνονται. Επομένως, είναι η θερμοκρασία εξάχνωσης. Εξάχνωση είναι η εξάτμιση ενός στερεού σε αέρια φάση χωρίς να περάσει από υγρή φάση.
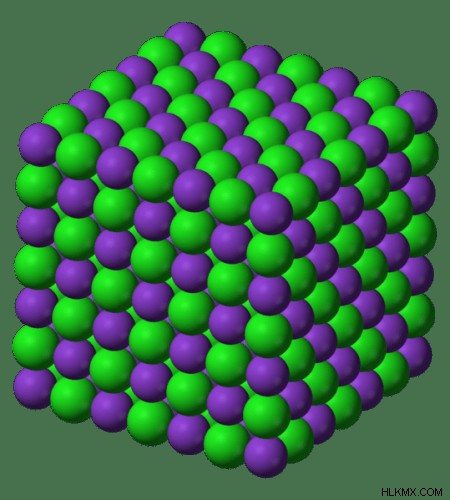
Εικόνα 2:Διάγραμμα δομής πλέγματος KCl
Το KCl είναι μια ιοντική ένωση. Αποτελείται από μικρά κατιόντα καλίου και μεγάλα ανιόντα χλωρίου. Η κρυσταλλική δομή του KCl είναι παρόμοια με αυτή του NaCl. Διαθέτει κυψέλες κυβικής μονάδας με επίκεντρο το πρόσωπο. Οι κρύσταλλοι KCl διασπώνται εύκολα σε τρεις κατευθύνσεις.
Ομοιότητες μεταξύ γλυκονικού καλίου και χλωριούχου καλίου
- Και τα δύο είναι ενώσεις που περιέχουν κατιόντα καλίου.
- Και τα δύο είναι εύκολα διαλυτά στο νερό.
- Τα διαλύματα και των δύο ενώσεων έχουν αλατούχα γεύση.
Διαφορά μεταξύ γλυκονικού καλίου και χλωριούχου καλίου
Ορισμός
Γλυκονικό κάλιο: Το γλυκονικό κάλιο είναι το άλας καλίου της συζυγούς βάσης του γλυκονικού οξέος.
Χλωριούχο κάλιο: Το χλωριούχο κάλιο είναι ένα αλογονίδιο μετάλλου που έχει τον χημικό τύπο KCl.
Χημικός τύπος
Γλυκονικό κάλιο: Ο χημικός τύπος του γλυκονικού καλίου είναι C6 H11 KO7 .
Χλωριούχο κάλιο: Ο χημικός τύπος του χλωριούχου καλίου είναι KCl.
Μοριακή μάζα
Γλυκονικό κάλιο: Η μοριακή μάζα του γλυκονικού καλίου είναι 234,246 g/mol.
Χλωριούχο κάλιο: Η μοριακή μάζα του χλωριούχου καλίου είναι 74,548 g/mol.
Σημείο τήξης και σημείο βρασμού
Γλυκονικό κάλιο: Το σημείο τήξης του γλυκονικού καλίου είναι περίπου 175°C.
Χλωριούχο κάλιο: Το σημείο τήξης του χλωριούχου καλίου είναι 770°C και το σημείο βρασμού είναι 1420°C. Στους 2732C, οι κρύσταλλοι KCl υψώνονται.
Γεύση
Γλυκονικό κάλιο: Τα διαλύματα γλυκονικού καλίου έχουν ελαφρά αλατούχα γεύση.
Χλωριούχο κάλιο: Τα διαλύματα χλωριούχου καλίου έχουν έντονη αλατούχα γεύση.
Εξάχνωση
Γλυκονικό κάλιο: Το γλυκονικό κάλιο δεν υφίσταται εξάχνωση.
Χλωριούχο κάλιο: Το χλωριούχο κάλιο μπορεί να υποστεί εξάχνωση.
Συμπέρασμα
Το κάλιο είναι ένα εξαιρετικά αντιδραστικό χημικό στοιχείο που μπορεί να σχηματίσει πολλές χημικές ενώσεις. Το γλυκονικό κάλιο και το χλωριούχο κάλιο είναι δύο τέτοιες ενώσεις. Η κύρια διαφορά μεταξύ του γλυκονικού καλίου και του χλωριούχου καλίου είναι ότι το γλυκονικό κάλιο Το γλυκονικό κάλιο είναι το άλας καλίου της συζυγούς βάσης του γλυκονικού οξέος, ενώ το χλωριούχο κάλιο είναι αλογονίδιο μετάλλου του καλίου.
Αναφορά:
1. «Γλυκονικό κάλιο». Εθνικό Κέντρο Πληροφοριών Βιοτεχνολογίας. Βάση δεδομένων PubChem Compound, Εθνική Βιβλιοθήκη Ιατρικής των ΗΠΑ, Διατίθεται εδώ.
2. "Χλωριούχο κάλιο." Wikipedia, Wikimedia Foundation, 31 Δεκεμβρίου 2017, Διαθέσιμο εδώ.
3. "Χλωριούχο κάλιο." Εθνικό Κέντρο Πληροφοριών Βιοτεχνολογίας. Βάση δεδομένων PubChem Compound, Εθνική Βιβλιοθήκη Ιατρικής των ΗΠΑ, Διατίθεται εδώ.
Εικόνα Ευγενική προσφορά:
1. «Gluconate Potassium» Από Fvasconcellos 01:39, 8 Οκτωβρίου 2007 (UTC) – Δικό έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia2. "Potassium-chloride-3D-ionic" By Benjah-bmm27 – Ίδιο έργο (Public Domain) μέσω Commons Wikimedia




