Διαφορά μεταξύ λιθίου και άλλων αλκαλικών μετάλλων
Κύρια διαφορά – Λίθιο έναντι άλλων αλκαλικών μετάλλων
Ο όρος αλκαλιμέταλλο χρησιμοποιείται για να ονομάσει τα στοιχεία της ομάδας 1 του περιοδικού πίνακα εξαιρουμένου του υδρογόνου. Ως εκ τούτου, τα αλκαλικά μέταλλα περιλαμβάνουν το λίθιο, το νάτριο, το κάλιο, το ρουβίδιο, το καίσιο και το φράγκιο. Μοιράζονται κάποιες κοινές χημικές και φυσικές ιδιότητες, αλλά έχουν και κάποιες διαφορετικές ιδιότητες. Αυτά τα στοιχεία περιλαμβάνονται στην ομάδα 1 του περιοδικού πίνακα επειδή το εξώτατο ηλεκτρόνιο των ατόμων τους βρίσκεται σε ένα τροχιακό s σε μορφή ns. Είναι γνωστά ως αλκαλιμέταλλα αφού οι ενώσεις που σχηματίζουν είναι πολύ αλκαλικές (βασικές ενώσεις). Το λίθιο είναι το μικρότερο αλκαλιμέταλλο μεταξύ άλλων αλκαλιμετάλλων. Η κύρια διαφορά μεταξύ του λιθίου και άλλων αλκαλιμετάλλων είναι ότι το λίθιο είναι το μόνο αλκαλικό μέταλλο που αντιδρά με το άζωτο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Λίθιο
– Ορισμός, χημικά στοιχεία, μοναδικές ιδιότητες
2. Τι είναι τα Αλκαλιμέταλλα
– Ορισμός, Μέλη Ομάδας, Γενικές Ιδιότητες
3. Ποια είναι η διαφορά μεταξύ λιθίου και άλλων αλκαλιμετάλλων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αλκαλικά μέταλλα, αλκαλικό, ανιόν, Βασικό, καίσιο, κατιόν, φράγκιο, λίθιο, κάλιο, ραδιενεργό, ρουβίδιο, νάτριο

Τι είναι το λίθιο
Το λίθιο είναι ένα αλκαλιμέταλλο με το χημικό σύμβολο "Li". Πιστεύεται ότι το λίθιο είναι ένα από τα μόνα τρία στοιχεία που παρήχθησαν σε σημαντικές ποσότητες από το Big Bang, άλλα δύο στοιχεία είναι το Υδρογόνο και το Ήλιο. Ακολουθούν ορισμένα χημικά στοιχεία του λιθίου.
- Ατομικός αριθμός – 3
- Ατομικό βάρος – 6.941
- Διαμόρφωση ηλεκτρονίου – [He] 2s
- Αποκλεισμός – μπλοκ
- Ομάδα – 1
- Περίοδος – 2
- Σημείο τήξης – 180,50 °C
- Σημείο βρασμού – 1330 °C
- Εμφάνιση – Ασημί λευκό, μεταλλικό
- Χρώμα φλόγας – Βυσσινί χρώμα
- Κοινά ισότοπα – Li, Li

Εικόνα 1:Το χρώμα της φλόγας λιθίου είναι βυσσινί.
Το λίθιο είναι πολύ ελαφρύ και μαλακό, δηλαδή μπορεί να κοπεί απλά χρησιμοποιώντας ένα μαχαίρι. Το λίθιο μπορεί να επιπλέει στο νερό και είναι εξαιρετικά αντιδραστικό. Η αντίδραση είναι συχνά εκρηκτική και παράγει υδροξείδιο του λιθίου. Ωστόσο, το λίθιο είναι το μόνο αλκαλικό μέταλλο που δεν μπορεί να σχηματίσει ανιόν. Αλλά το λίθιο σχηματίζει εύκολα το κατιόν Li, αφαιρώντας ένα από τα τρία ηλεκτρόνια του.
Παρόλο που το λίθιο έχει κάποιες παρόμοιες ιδιότητες με εκείνες άλλων αλκαλιμετάλλων, υπάρχουν επίσης μερικές διαφορετικές και μοναδικές ιδιότητες. Οι ενώσεις λιθίου απαιτούν περισσότερα οξέα για την εξουδετέρωση των αλκαλικών διαλυμάτων του από άλλα αλκαλικά μέταλλα. Με άλλα λόγια, το λίθιο σχηματίζει τα ισχυρότερα αλκαλικά διαλύματα. Το λίθιο είναι το μόνο αλκαλιμέταλλο που μπορεί να αντιδράσει με το άζωτο. Δίνει άλας νιτριδίου λιθίου. Σε θερμοκρασία και πίεση δωματίου, το μέταλλο λιθίου αντιδρά με το αέριο άζωτο ως εξής.
Li(s) + N2(g) → 2Li3 N(ες)
Το λίθιο έχει τη μικρότερη πυκνότητα μεταξύ των αλκαλικών μετάλλων. Δεν εμφανίζεται ελεύθερα στη φύση λόγω της υψηλής αντιδραστικότητάς του. Όταν το μέταλλο λιθίου διατηρείται εκτεθειμένο στον αέρα, οξειδώνεται γρήγορα, σχηματίζοντας επικάλυψη οξειδίου σε μαύρο χρώμα.
Τι είναι τα Αλκαλικά Μέταλλα
Τα αλκαλιμέταλλα είναι στοιχεία της ομάδας 1 εκτός του υδρογόνου. Ως εκ τούτου, τα μέλη αυτής της κατηγορίας περιλαμβάνουν λίθιο, νάτριο, κάλιο, ρουβίδιο, καίσιο και φράγκιο. Είναι γνωστά ως αλκαλιμέταλλα αφού οι ενώσεις που σχηματίζουν είναι αλκαλικές (βασικές ενώσεις).
Τα αλκαλιμέταλλα έχουν το εξώτατο ηλεκτρόνιό τους σε ένα τροχιακό s. Ως εκ τούτου, βρίσκονται στο μπλοκ s του περιοδικού πίνακα των στοιχείων. Έχουν το εξωτερικό τους ηλεκτρόνιο σε μορφή ns. Επομένως, βρίσκονται στην ομάδα 1 του περιοδικού πίνακα. Όλα σχηματίζουν το μονοσθενές κατιόν ως την πιο σταθερή κατάσταση οξείδωσης.
Όταν πηγαίνετε κάτω από την ομάδα των αλκαλιμετάλλων, υπάρχουν ορισμένες περιοδικές παραλλαγές όπως αναφέρονται παρακάτω.
- Το ατομικό μέγεθος αυξάνεται.
- Το σημείο τήξης και το σημείο βρασμού μειώνονται λόγω της ικανότητας σχηματισμού ισχυρών δεσμών στην ομάδα (όταν το άτομο μεγαλώσει, ο σχηματιζόμενος δεσμός είναι αδύναμος).
- Η πυκνότητα αυξάνεται.
- Η ενέργεια πρώτου ιονισμού μειώνεται. Επειδή στα μεγάλα άτομα, το πιο εξωτερικό ηλεκτρόνιο είναι χαλαρά δεσμευμένο και μπορεί εύκολα να αφαιρεθεί.
- Η ηλεκτροαρνητικότητα μειώνεται.
- Η αντιδραστικότητα μειώνεται.
- Τα αλκαλιμέταλλα έχουν χαμηλή συγγένεια ηλεκτρονίων από άλλα στοιχεία.
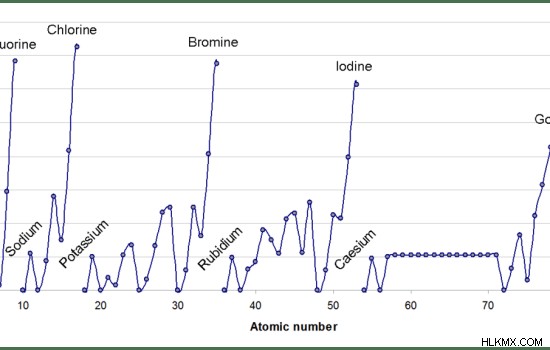
Εικόνα 2:Τα αλκαλικά μέταλλα έχουν χαμηλότερες συγγένειες ηλεκτρονίων από άλλα στοιχεία.
Αυτά είναι μόνο μερικά από τα ακίνητα. Τώρα, ας εξετάσουμε εν συντομία ορισμένα στοιχεία για τα μέλη αυτής της ομάδας.
Λίθιο
Το λίθιο είναι το μικρότερο στοιχείο μεταξύ των αλκαλικών μετάλλων. Περισσότερα στοιχεία για το λίθιο συζητούνται παραπάνω.
Νάτριο
Το νάτριο είναι ένα χημικό στοιχείο με ατομικό αριθμό 11 και χημικό σύμβολο "Na". Το ατομικό βάρος του νατρίου είναι περίπου 22,98 amu. Το σημείο τήξης είναι 97,79 °C και το σημείο βρασμού είναι 882,8 °C. Σε θερμοκρασία δωματίου και πίεση, το νάτριο βρίσκεται στη στερεή φάση. Αν και έχει μεταλλική γυαλιστερή εμφάνιση, είναι ένα μαλακό μέταλλο που μπορεί εύκολα να κοπεί χρησιμοποιώντας ένα μαχαίρι.
Το νάτριο είναι εξαιρετικά αντιδραστικό. Αντιδρά εύκολα με το οξυγόνο και το νερό. Ως εκ τούτου, η μεταλλική μορφή του νατρίου έχει λιγότερες εφαρμογές. Δεν μπορεί να χρησιμοποιηθεί ως δομικό υλικό γιατί είναι πολύ μαλακό και εξαιρετικά αντιδραστικό. Όταν καίγεται, το νάτριο δίνει μια κίτρινη-πορτοκαλί φλόγα. Όταν ένα μικροσκοπικό κομμάτι νατρίου προστίθεται στο νερό, δείχνει μια εξαιρετικά εκρηκτική αντίδραση.
Κάλιο
Το κάλιο είναι το τρίτο αλκαλικό μέταλλο που βρίσκεται στην ομάδα 1 του περιοδικού πίνακα. Το κάλιο είναι ένα στοιχείο που είναι απολύτως απαραίτητο τόσο για τα φυτά όσο και για τα ζώα. Ο Sir Humphry Davy απομόνωσε στοιχείο καλίου με ηλεκτρόλυση λιωμένου υδροξειδίου του καλίου (KOH). Το μέταλλο καλίου έχει απαλό και ασημί λευκό χρώμα. Έχει πολύ χαμηλό σημείο τήξης. Δεδομένου ότι είναι μέταλλο, είναι καλός ηλεκτρικός αγωγός. Το κάλιο είναι το έβδομο πιο άφθονο στοιχείο στη γη. Οι περισσότερες εμπορικά διαθέσιμες ενώσεις λαμβάνονται από ηλεκτρόλυση ορισμένων ενώσεων όπως ο καρναλλίτης, επειδή το στοιχειακό κάλιο υπάρχει σε αδιάλυτα στο νερό ιζήματα και πετρώματα, γεγονός που καθιστά δύσκολη την εξαγωγή τους.
Ρουβίδιο
Το ρουβίδιο είναι ένα χημικό στοιχείο με το σύμβολο Rb και είναι αλκαλιμέταλλο. Είναι ένα μαλακό μέταλλο με ασημί λευκή εμφάνιση. Είναι εξαιρετικά αντιδραστικό. Έχει μερικά ισότοπα που είναι ελαφρώς ραδιενεργά. Το μέταλλο ρουβίδιο εξατμίζεται εύκολα. Το σημείο τήξης είναι 39,30 °C και το σημείο βρασμού είναι 688 °C. Αλλά σε θερμοκρασία δωματίου, είναι σε στερεή κατάσταση.
Καίσιο
Το καίσιο είναι ένα χημικό στοιχείο που έχει το χημικό σύμβολο Cs. Ο ατομικός αριθμός του καισίου είναι 55. Έχει όψη ανοιχτού χρυσού. Το τυπικό ατομικό βάρος αυτού του μετάλλου είναι 132,9 amu. Είναι σε στερεή φάση σε θερμοκρασία δωματίου. Το σημείο τήξης είναι 28,5 °C και το σημείο βρασμού είναι 671 °C. Έχει μόνο ένα σταθερό ισότοπο και άλλα ισότοπα είναι ραδιενεργά.
Φράγκιο
Το φράγκιο είναι ένα χημικό στοιχείο με σύμβολο Fr και ατομικό αριθμό 87. Είναι το δεύτερο λιγότερο ηλεκτραρνητικό χημικό στοιχείο. Είναι από τα πιο σπάνια χημικά στοιχεία που υπάρχουν στη φύση. Το φράγκιο είναι εξαιρετικά ραδιενεργό.
Διαφορά μεταξύ λιθίου και άλλων αλκαλικών μετάλλων
Ορισμός
Λίθιο: Το λίθιο είναι ένα αλκαλικό μέταλλο με το χημικό σύμβολο "Li".
Άλλα μέταλλα αλκαλίων: Τα αλκαλιμέταλλα είναι στοιχεία της ομάδας 1 εκτός του υδρογόνου.
Αντίδραση με άζωτο
Λίθιο: Το λίθιο είναι το μόνο αλκαλικό μέταλλο που μπορεί να αντιδράσει με το αέριο άζωτο και σχηματίζει νιτρίδιο λιθίου.
Άλλα μέταλλα αλκαλίων: Εκτός από το λίθιο, άλλα αλκαλιμέταλλα δεν μπορούν να αντιδράσουν με το αέριο άζωτο.
Ατομικό μέγεθος
Λίθιο: Το λίθιο είναι το μικρότερο μεταξύ των αλκαλικών μετάλλων.
Άλλα μέταλλα αλκαλίων: Το ατομικό μέγεθος των αλκαλιμετάλλων αυξάνεται στην ομάδα.
Ατομικός αριθμός
Λίθιο: Ο ατομικός αριθμός του λιθίου είναι 3, η μικρότερη τιμή μεταξύ των αλκαλικών μετάλλων.
Άλλα μέταλλα αλκαλίων: Τα αλκαλιμέταλλα έχουν διαφορετικούς ατομικούς αριθμούς, ο μικρότερος είναι 3 (λίθιο) και ο υψηλότερος 87 (φράγκιο).
Πυκνότητα
Λίθιο: Το λίθιο έχει τη μικρότερη πυκνότητα μεταξύ των στερεών μετάλλων.
Άλλα μέταλλα αλκαλίων: Η πυκνότητα των αλκαλικών μετάλλων αυξάνεται προς τα κάτω.
Σχηματισμός ανιόντων
Λίθιο: Το λίθιο είναι το μόνο αλκαλιμέταλλο που δεν μπορεί να σχηματίσει ανιόν.
Άλλα μέταλλα αλκαλίων: Άλλα αλκαλικά μέταλλα μπορεί να σχηματίσουν ανιόντα είτε σε στερεή είτε σε υγρή φάση.
Βασικό
Λίθιο: Το λίθιο είναι το ισχυρότερο βασικό αλκαλικό μέταλλο που απαιτεί περισσότερα οξέα για την εξουδετέρωση των διαλυμάτων που περιέχουν λίθιο.
Άλλα μέταλλα αλκαλίων: Τα αλκαλιμέταλλα έχουν διαφορετικές βασικές ιδιότητες.
Συμπέρασμα
Τα αλκαλιμέταλλα είναι χημικά στοιχεία που σχηματίζουν ενώσεις με βασικές ιδιότητες. Τα μέλη αυτής της ομάδας περιλαμβάνουν το λίθιο, το νάτριο, το κάλιο, το ρουβίδιο, το καίσιο και το φράγκιο. Η κύρια διαφορά μεταξύ του λιθίου και άλλων αλκαλιμετάλλων είναι ότι το λίθιο είναι το μόνο αλκαλιμέταλλο που αντιδρά με το άζωτο.
Αναφορά:
1. Παππάς, Στεφανία. "Στοιχεία για το λίθιο." LiveScience, Purch, 23 Σεπτεμβρίου 2015, Διαθέσιμο εδώ.
2. Dye, James L. "Lithium." Encyclopædia Britannica, Encyclopædia Britannica, inc., 3 Ιανουαρίου 2018, Διαθέσιμο εδώ.
3. "Αλκαλικό μέταλλο." Wikipedia, Ίδρυμα Wikimedia, 5 Ιανουαρίου 2018, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Δοκιμή φλόγας λιθίου» By Chemicalinterest – Δική εργασία (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. «Συγγένειες ηλεκτρονίων των στοιχείων» Από Sandbh – Δική μου εργασία (CC BY-SA 3.0) μέσω Commons Wikimedia