Διαφορά μεταξύ υδροχλωρίου και υδροχλωρικού οξέος
Κύρια διαφορά – Υδροχλωρίδιο έναντι υδροχλωρικού οξέος
Το υδροχλώριο και το υδροχλωρικό οξύ είναι δύο όροι που χρησιμοποιούνται για την ονομασία χημικών ενώσεων που έχουν τον ίδιο χημικό τύπο:HCl. Το υδροχλώριο είναι το όνομα της ένωσης HCl που μπορεί να βρίσκεται σε οποιαδήποτε φάση της ύλης:στερεή, υγρή ή αέρια. Αλλά σε θερμοκρασία δωματίου, είναι ένα άχρωμο αέριο. Το υδροχλωρικό οξύ είναι το υδατικό διάλυμα υδροχλωρίου που έχει όξινες ιδιότητες. Επομένως, η κύρια διαφορά μεταξύ υδροχλωρίου και υδροχλωρικού οξέος είναι ότιτο υδροχλώριο είναι ένα άχρωμο αέριο σε θερμοκρασία δωματίου, ενώ το υδροχλωρικό οξύ είναι ένα διάλυμα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το υδροχλώριο
– Ορισμός, χημική δομή και ιδιότητες
2. Τι είναι το Υδροχλωρικό Οξύ
– Ορισμός, χημικές ιδιότητες και αντιδράσεις
3. Ποια είναι η διαφορά ανάμεσα στο υδροχλώριο και το υδροχλωρικό οξύ
– Σύγκριση βασικών διαφορών
Βασικοί όροι:οξύ, χλωράνιο, κυβικό, υδροχλωρικό οξύ, υδροχλώριο, ορθορομβικό, μετάβαση φάσης, πολικός ομοιοπολικός δεσμός

Τι είναι το υδροχλώριο
Το υδροχλώριο είναι μια χημική ένωση που έχει τον χημικό τύπο HCl. Είναι ένα υδραλογόνο. Το υδροχλώριο είναι αέριο σε θερμοκρασία και πίεση δωματίου. Αυτό το αέριο έχει μια πικάντικη, έντονη οσμή. Σχηματίζει λευκούς αναθυμιάσεις κατά την επαφή με τους ατμοσφαιρικούς υδρατμούς.
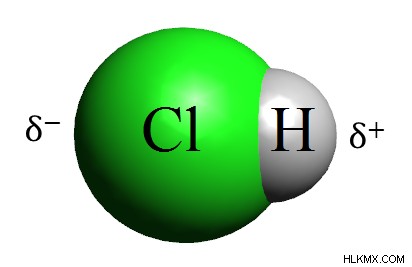
Εικόνα 1:Το υδροχλώριο είναι ένα πολικό μόριο
Το σημείο τήξης του υδροχλωρίου είναι −114,22 °C και το σημείο βρασμού είναι −85,05 °C. Το υδροχλώριο είναι ένα διατομικό μόριο. Το άτομο υδρογόνου και το άτομο χλωρίου συνδέονται μεταξύ τους μέσω ομοιοπολικού δεσμού. Ο δεσμός μεταξύ των δύο ατόμων είναι ένας πολικός ομοιοπολικός δεσμός. Δεδομένου ότι το άτομο του χλωρίου είναι πιο ηλεκτραρνητικό από το άτομο του υδρογόνου, το άτομο του χλωρίου έλκει ηλεκτρόνια περισσότερο από το άτομο του υδρογόνου, καθιστώντας τον δεσμό πολικό.
Λόγω της υψηλής πολικότητας του, τα μόρια υδροχλωρίου είναι καλά διαλυτά στο νερό. Όταν το υδροχλώριο διαλύεται στο νερό, σχηματίζει υδροχλωρικό οξύ. Το υδροχλώριο είναι επίσης διαλυτό σε άλλους πολικούς διαλύτες. Τα κατεψυγμένα μόρια HCl υφίστανται μετάβαση φάσης σε θερμοκρασία 98,4 Κ. Η μετάβαση γίνεται από την ορθορομβική στην κυβική δομή (πρόσωπο-κεντρική).
Τι είναι το υδροχλωρικό οξύ
Το υδροχλωρικό οξύ είναι ένα ισχυρό οξύ με χημικό τύπο HCl. Είναι πολύ διαβρωτικό στη συμπυκνωμένη του μορφή. Το υδροχλωρικό οξύ είναι ένα άχρωμο διάλυμα που παρασκευάζεται με διάλυση υδροχλωρίου (HCl) σε νερό. Η μοριακή μάζα του υδροχλωρικού οξέος είναι περίπου 36,5 g/mol. Η ονομασία IUPAC του υδροχλωρικού οξέος είναι χλωράνιο .
Το υδροχλωρικό οξύ είναι μονοπρωτικό οξύ. Αυτό σημαίνει ότι το υδροχλωρικό οξύ απελευθερώνει ένα πρωτόνιο (Η) ανά μόριο στο υδατικό του διάλυμα. Επομένως, το υδροχλωρικό οξύ διασπάται πλήρως στο νερό. Έτσι, έχει υψηλή τιμή για σταθερά διάστασης οξέος (Ka ).
Το υδροχλωρικό οξύ έχει πολλές εφαρμογές σε εργαστηριακή και βιομηχανική κλίμακα. Μια τέτοια εφαρμογή σε βιομηχανική κλίμακα είναι η διύλιση μετάλλων. Αυτό το οξύ χρησιμοποιείται στη διύλιση μετάλλων επειδή τα περισσότερα μέταλλα διαλύονται εύκολα σε αυτό.

Εικόνα 2:Το υδροχλωρικό οξύ είναι ένα ισχυρό οξύ. Μπορεί να γίνει μπλε κόκκινο λυχνία
Μια άλλη σημαντική εφαρμογή του υδροχλωρικού οξέος είναι η αποξήρανση του χάλυβα, δηλαδή η αφαίρεση της σκουριάς (οξειδίου του σιδήρου) από σίδηρο ή χάλυβα. Η αντίδραση που εμφανίζεται εδώ δίνεται παρακάτω.
Φε2 O3 + Fe + 6HCl → 3FeCl3 + 3H2 O
Επιπλέον, το υδροχλωρικό οξύ είναι ένας ήπιος αναγωγικός παράγοντας. Υποβάλλεται σε αντιδράσεις οξειδοαναγωγής με ισχυρούς οξειδωτικούς παράγοντες όπως MnO2 .
MnO2(aq) + HCl(aq) → MnCl2(aq) + Cl2(g) + H2 O(l)
Ομοιότητες μεταξύ Υδροχλωρίου και Υδροχλωρικού Οξέος
- Και τα δύο έχουν τον ίδιο χημικό τύπο και την ίδια μοριακή μάζα.
- Και οι δύο είναι όξινες ενώσεις.
- Και τα δύο είναι καλά διαλυτά στο νερό.
- Και οι δύο ενώσεις σχηματίζουν λευκούς ατμούς όταν εκτίθενται σε ατμοσφαιρικούς υδρατμούς.
Διαφορά μεταξύ υδροχλωρίου και υδροχλωρικού οξέος
Ορισμός
Υδροχλώριο: Το υδροχλώριο είναι μια χημική ένωση που έχει τον χημικό τύπο HCl.
Υδροχλωρικό οξύ: Το υδροχλωρικό οξύ είναι ένα ισχυρό οξύ με χημικό τύπο HCl.
Φύση
Υδροχλώριο: Το υδροχλώριο είναι μια ένωση υδραλογόνου.
Υδροχλωρικό οξύ: Το υδροχλωρικό οξύ είναι ένα όξινο διάλυμα.
Φάση
Υδροχλώριο: Το υδροχλώριο είναι ένα άχρωμο αέριο σε θερμοκρασία δωματίου.
Υδροχλωρικό οξύ: Το υδροχλωρικό οξύ είναι ένα υδατικό διάλυμα σε θερμοκρασία δωματίου.
Όνομα IUPAC
Υδροχλώριο: Το όνομα IUPAC και η κοινή ονομασία του υδροχλωρίου είναι το ίδιο.
Υδροχλωρικό οξύ: Η ονομασία IUPAC υδροχλωρικό οξύ είναι chlorane.
Συμπέρασμα
Το υδροχλώριο και το υδροχλωρικό οξύ είναι χημικές ενώσεις που έχουν μόρια HCl. Βασικά, το υδροχλωρικό οξύ είναι ένα υδατικό διάλυμα υδροχλωρίου. Η κύρια διαφορά μεταξύ του υδροχλωρίου και του υδροχλωρικού οξέος είναι ότι το υδροχλώριο είναι ένα άχρωμο αέριο σε θερμοκρασία δωματίου, ενώ το υδροχλωρικό οξύ είναι ένα διάλυμα.
Αναφορά:
1. «Υδροχλωρικό οξύ». Wikipedia, Ίδρυμα Wikimedia, 6 Ιανουαρίου 2018, Διαθέσιμο εδώ.
2. Lazonby, John. «Υδροχλώριο». The Essential Chemical Industry, Διατίθεται εδώ.
Εικόνα Ευγενική προσφορά:
1. «Dipolna molekula HCl» Του Drago Karlo – Δικό έργο (CC BY-SA 4.0) μέσω Commons Wikimedia
2. "Hydrochloric acid 04" By Walkerma στο en.wikipedia – Ίδια εργασία. Μεταφέρθηκε από το en.wikipedia στα Commons από χρήστη:Logan χρησιμοποιώντας CommonsHelper (Δημόσιος Τομέας) μέσω Commons Wikimedia




