Διαφορά μεταξύ χλωροφορμίου και χλωρίου
Κύρια διαφορά – Χλωροφόρμιο vs Χλώριο
Το χλώριο είναι ένα χημικό στοιχείο με ατομικό αριθμό 17. Αλλά γενικά, ο όρος χλώριο χρησιμοποιείται για να ονομάσουμε αέριο χλώριο, τη διατομική αέρια ένωση του χλωρίου. Το αέριο χλώριο και άλλες ενώσεις που περιέχουν χλώριο είναι πολύ χρήσιμα ως απολυμαντικό και για την κατασκευή άλλων προϊόντων. Το χλωροφόρμιο είναι μια κοινή αναισθητική ένωση που σχηματίζεται από την αντίδραση μεταξύ μεθανίου και αερίου χλωρίου. Η κύρια διαφορά μεταξύ χλωροφορμίου και χλωρίου είναι ότι το χλωροφόρμιο υπάρχει ως υγρό σε θερμοκρασία δωματίου και έχει μια βαριά οσμή που μοιάζει με αιθέρα και μια γλυκιά γεύση, ενώ το χλώριο υπάρχει ως κιτρινοπράσινο αέριο και έχει μια ασφυκτική μυρωδιά.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το χλωροφόρμιο
– Ορισμός, Χημικές ιδιότητες, Παραγωγή, Χρήσεις
2. Τι είναι το Χλώριο
– Ορισμός, Χημικές ιδιότητες, Χρήσεις
3. Ποια είναι η διαφορά μεταξύ χλωροφορμίου και χλωρίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ατομικός αριθμός, Χλώριο, Χλώριο, Χλωροφόρμιο, Αλογόνωση ελεύθερων ριζών, Ισότοπο, Μέθανο, Τετραεδρικό, Τριχλωρομεθάνιο

Τι είναι το χλωροφόρμιο
Το χλωροφόρμιο είναι ένα κοινό αναισθητικό (μια ουσία που προκαλεί αναισθησία στον πόνο) χημικά είδη που έχουν τον χημικό τύπο CHCl3 . Η μοριακή μάζα αυτής της ένωσης είναι 119,369 g/mol. Ονομάζεται επίσης τριχλωρομεθάνιο επειδή η χημική δομή του χλωροφορμίου μοιάζει με μεθάνιο με τρία άτομα υδρογόνου που έχουν υποκατασταθεί από άτομα χλωρίου.
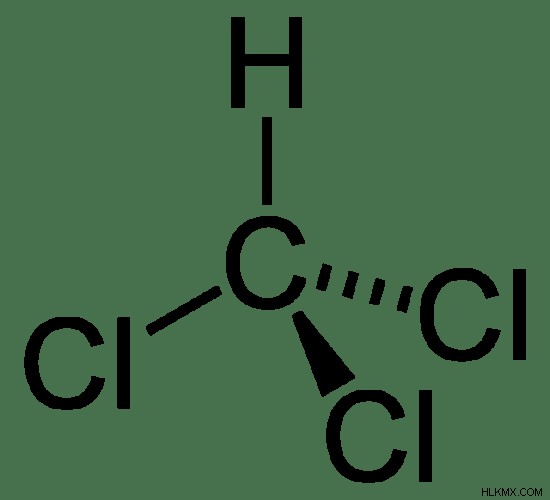
Εικόνα 1:Χημική δομή του χλωροφορμίου
Σε θερμοκρασία δωματίου, το χλωροφόρμιο υπάρχει ως άχρωμο υγρό που είναι εξαιρετικά πτητικό. Έχει βαριά μυρωδιά σαν αιθέρα και γλυκιά γεύση. Το σημείο τήξης του χλωροφορμίου είναι −63,5 °C και το σημείο βρασμού είναι 61,15 °C. Αλλά αποσυντίθεται στους 450 °C. Το χλωροφόρμιο είναι ελαφρώς διαλυτό στο νερό αλλά είναι καλά διαλυτό σε οργανικούς διαλύτες όπως το βενζόλιο. Το χλωροφόρμιο είναι πιο πυκνό από το νερό (1,489 g/cm στους 25 C). Η γεωμετρία του μορίου του χλωροφορμίου είναι τετραεδρική.

Εικόνα 2:Χλωροφόρμιο
Το χλωροφόρμιο παράγεται μέσω χλωρίωσης μεθανίου. Εδώ, ένα μείγμα χλωρίου και μεθανίου θερμαίνεται στους 400C περίπου. Η χλωρίωση λαμβάνει χώρα ως αλογόνωση ελεύθερων ριζών.
CH4 + Cl2 → CH3 Cl + HCl
CH3 Cl + Cl2 → CH2 Cl2 + HCl
CH2 Cl2 + Cl2 → CHCl3 + HCl
Η πιο σημαντική χρήση του χλωροφορμίου είναι η παραγωγή μονοχλωροδιφθορομεθανίου (CFC-22) μέσω της αντίδρασης μεταξύ χλωροφορμίου και HF (υδροφθόριο). Χρησιμοποιείται επίσης ως διαλύτης για λίπη, έλαια, καουτσούκ κ.λπ. Όταν τα άτομα υδρογόνου του χλωροφορμίου αντικατασταθούν με ισότοπο δευτερίου, δίνει CDCl3 , ο οποίος είναι ο διαλύτης που χρησιμοποιείται στη φασματοσκοπία NMR. Ωστόσο, η πιο κοινή χρήση του χλωροφορμίου είναι η χρήση του ως αναισθητικό. Χρησιμοποιήθηκε ευρέως σε χειρουργεία και σε εγκληματικές δραστηριότητες επίσης. Ωστόσο, η χρήση του χλωροφορμίου στις χειρουργικές επεμβάσεις ελέγχεται πλέον αυστηρά καθώς μπορεί να προκαλέσουν ηπατική βλάβη.
Τι είναι το χλώριο
Το χλώριο είναι ένα χημικό στοιχείο με ατομικό αριθμό 17. Το χλώριο ανήκει στην ομάδα 17 του περιοδικού πίνακα, η οποία ονομάζεται ομάδα αλογόνου και ανήκει στο μπλοκ p. Είναι ένα μη μέταλλο. Η ηλεκτρονιακή διαμόρφωση του χλωρίου είναι [Ne]3s3p. Του λείπει ένα ηλεκτρόνιο για να γεμίσει πλήρως τα τροχιακά. Ως εκ τούτου, τα άτομα χλωρίου είναι πολύ αντιδραστικά. Το χλώριο σχηματίζει ανιόντα με -1 ηλεκτρικό φορτίο κερδίζοντας ένα ηλεκτρόνιο από το εξωτερικό προκειμένου να ολοκληρωθεί η διαμόρφωση των ηλεκτρονίων. Αλλά γενικά, το όνομα χλώριο χρησιμοποιείται για την ονομασία του διατομικού αερίου χλωρίου (Cl2 ).

Εικόνα 3:Αέριο χλώριο σε μια σφαίρα
Σε θερμοκρασία και πίεση δωματίου, το χλώριο υπάρχει ως κιτρινοπράσινο αέριο. Το αέριο χλώριο έχει μια ασφυκτική μυρωδιά. Υπάρχουν λίγα ισότοπα χλωρίου. Τα πιο κοινά ισότοπα είναι το Chlorine-35 και το chlorine-37. Ωστόσο, το χλώριο-35 είναι το πιο άφθονο ισότοπο μεταξύ αυτών των δύο λόγω της υψηλής σταθερότητάς του. Η πιο σταθερή κατάσταση οξείδωσης του χλωρίου είναι -1. Λαμβάνοντας ένα ηλεκτρόνιο από το εξωτερικό (από ένα χημικό είδος που δίνει ηλεκτρόνιο), το άτομο χλωρίου μπορεί να αποκτήσει μια σταθερή διαμόρφωση ηλεκτρονίων ολοκληρώνοντας τη διαμόρφωση ηλεκτρονίων.
Το αέριο χλώριο και οι περισσότερες άλλες ενώσεις που περιέχουν χλώριο μπορούν να σκοτώσουν τα βακτήρια. Ως εκ τούτου, χρησιμοποιείται ως απολυμαντικό για την επεξεργασία του πόσιμου νερού και του νερού της πισίνας. Ωστόσο, το αέριο χλώριο χρησιμοποιείται κυρίως στην παραγωγή PVC (πολυβινυλοχλωρίδιο).
Το αέριο χλώριο μπορεί να χρησιμοποιηθεί ως οξειδωτικός παράγοντας επειδή Cl2 μπορεί να αναχθεί για να σχηματίσει ιόντα χλωρίου (τα κλανιόν είναι γνωστά ως ιόντα χλωρίου). Μια άλλη σημαντική εφαρμογή του χλωρίου είναι στην παραγωγή ιόντων χλωροφορμίου, το οποίο είναι αναισθητικό.
Διαφορά μεταξύ χλωροφορμίου και χλωρίου
Ορισμός
Χλωροφόρμιο: Το χλωροφόρμιο είναι ένα κοινό αναισθητικό χημικό είδος που έχει τον χημικό τύπο CHCl3 .
Χλώριο: Το χλώριο είναι ένα χημικό στοιχείο που έχει τον ατομικό αριθμό 17 και το σύμβολο Cl. Αλλά γενικά, το διατομικό χλώριο ονομάζεται επίσης χλώριο.
Μοριακή μάζα
Χλωροφόρμιο: Η μοριακή μάζα του χλωροφορμίου είναι 119,369 g/mol.
Χλώριο: Το ατομικό βάρος του ατόμου χλωρίου είναι 35,453 amu.
Φύση
Χλωροφόρμιο: Το χλωροφόρμιο είναι ένα πτητικό υγρό σε θερμοκρασία δωματίου.
Χλώριο: Το χλώριο είναι ένα διατομικό αέριο σε θερμοκρασία δωματίου.
Φυσικές ιδιότητες
Χλωροφόρμιο: Το χλωροφόρμιο έχει μια βαριά μυρωδιά που μοιάζει με αιθέρα και μια γλυκιά γεύση.
Χλώριο: Σε θερμοκρασία και πίεση δωματίου, το χλώριο υπάρχει ως κιτρινοπράσινο αέριο και έχει μια ασφυκτική μυρωδιά.
Χρησιμοποιήσεις
Χλωροφόρμιο: Το χλωροφόρμιο χρησιμοποιείται για την παραγωγή μονοχλωροδιφθορομεθανίου και χρησιμοποιείται ως διαλύτης για λίπη, έλαια, καουτσούκ κ.λπ. Χρησιμοποιήθηκε ως αναισθητικό χημικό, αλλά τώρα η χρήση είναι ελεγχόμενη.
Χλώριο: Οι ενώσεις που περιέχουν χλώριο χρησιμοποιούνται κυρίως ως απολυμαντικά και το χλώριο χρησιμοποιείται για την παραγωγή χημικών ενώσεων όπως το PVC.
Συμπέρασμα
Το χλωροφόρμιο παράγεται από την αντίδραση αλογόνωσης ελεύθερων ριζών μεταξύ μεθανίου και χλωρίου. Το χλωροφόρμιο χρησιμοποιήθηκε συνήθως ως αναισθητικό χημικό, αλλά τώρα η χρήση του ελέγχεται λόγω της βλάβης του στο ήπαρ. Το χλώριο είναι ένα χημικό στοιχείο με ατομικό αριθμό 17. Σε θερμοκρασία δωματίου, υπάρχει ως διατομικό αέριο χλώριο. Η κύρια διαφορά μεταξύ χλωροφορμίου και χλωρίου είναι ότι το χλωροφόρμιο υπάρχει ως υγρό σε θερμοκρασία δωματίου και έχει μια βαριά μυρωδιά που μοιάζει με αιθέρα, ενώ το χλώριο υπάρχει ως κιτρινοπράσινο αέριο και έχει μια ασφυκτική μυρωδιά.
Αναφορά:
1. «Χλώριο – Πληροφορίες στοιχείων, ιδιότητες και χρήσεις | Περιοδικός Πίνακας." Royal Society of Chemistry, Διαθέσιμο εδώ.
2. "CHLOROFORM." Εθνικό Κέντρο Πληροφοριών Βιοτεχνολογίας. Βάση δεδομένων PubChem Compound, U.S. National Library of Medicine, Διαθέσιμο εδώ.
3. Carey, Francis A. "Chloroform." Encyclopædia Britannica, Encyclopædia Britannica, inc., 15 Νοεμβρίου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Χλωροφόρμιο που εμφανίζεται» Με αρχική εικόνα από τον Benjah-bmm27, διανυσματική από τον Fvasconcellos – Εικόνα:Chloroform-2D.png (Δημόσιος Τομέας) μέσω του Commons Wikimedia
2. «Χλωροφόρμιο από τον Danny S. – 002» Από τον Danny S . – Δικό έργο (CC BY-SA 3.0) μέσω Commons Wikimedia
3. «Chlorine sphere» του W. Oelen – (CC BY-SA 3.0) μέσω Commons Wikimedia