Διαφορά μεταξύ οργανικών και ανόργανων φωσφορικών αλάτων
Κύρια διαφορά – Οργανικό έναντι Ανόργανου Φωσφορικού
Τα φωσφορικά άλατα είναι ενώσεις που αποτελούνται από μονάδες φωσφορικών (-PO4 μονάδες). Υπάρχουν διάφοροι τύποι φωσφορικών αλάτων όπως τα οργανικά φωσφορικά και τα ανόργανα φωσφορικά άλατα. Τα οργανικά φωσφορικά είναι επίσης γνωστά ως οργανοφωσφορικά και είναι εστέρες του φωσφορικού οξέος. Τα ανόργανα φωσφορικά είναι άλατα του φωσφορικού οξέος. Έχουν διαφορετικές εφαρμογές ανάλογα με τις χημικές και φυσικές τους ιδιότητες. Η κύρια διαφορά μεταξύ των οργανικών φωσφορικών και των ανόργανων φωσφορικών είναι ότι τα οργανικά φωσφορικά είναι εστερικές ενώσεις ενώ τα ανόργανα φωσφορικά είναι ανόργανα άλατα .
Βασικές περιοχές που καλύπτονται
1. Τι είναι ένα οργανικό φωσφορικόι
– Ορισμός, Παραδείγματα, Χρήσεις
2. Τι είναι ένα ανόργανο φωσφορικόι
– Ορισμός, Δομή, Χρήσεις
3. Ποια είναι η διαφορά μεταξύ οργανικών και ανόργανων φωσφορικών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Συμπυκνωμένα φωσφορικά άλατα, εστέρας, λίπασμα, ανόργανο φωσφορικό, οργανικό φωσφορικό, ορθοφωσφορικά, φυτοφάρμακα, φωσφορικά, αλάτι

Τι είναι το Organic Phosphate
Οι οργανικές φωσφορικές ενώσεις είναι επίσης γνωστές ως οργανοφωσφορικά . Είναι ένας φωσφορικός εστέρας ή ένας εστέρας του φωσφορικού οξέος. Ο χημικός τύπος του φωσφορικού οξέος είναι H3 PO4 . Ένας εστέρας σχηματίζεται όταν ένα άτομο υδρογόνου ενός υδρογονάνθρακα αντικαθίσταται από φωσφορικό οξύ. Στη συνέχεια η κατάσταση του οξέος αλλάζει από ανόργανο σε οργανικό.
Ο όρος οργανοφωσφορικά χρησιμοποιείται ευρέως στη γεωργία. Τα οργανοφωσφορικά φυτοφάρμακα μπορούν να δράσουν ως θανατικός παράγοντας αναστέλλοντας ορισμένα ένζυμα των παρασίτων. Μερικές ευρέως χρησιμοποιούμενες οργανοφωσφορικές ενώσεις περιλαμβάνουν το παραθείο, το μαλαθείο, το διχλωρόβος, το διαζίνον κ.λπ.
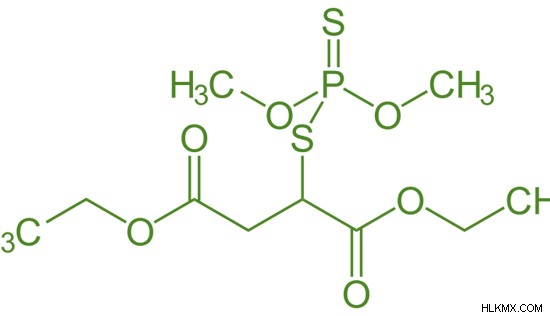
Εικόνα 1:Χημική Δομή του Μαλαθείου
Δεδομένου ότι τα οργανικά φωσφορικά άλατα αποτελούνται από φωσφορικές ομάδες που συνδέονται με οργανικές ομάδες, αυτές οι ενώσεις μπορούν να χρησιμοποιηθούν σε μεγάλη ποικιλία εφαρμογών. Οι οργανικές ομάδες μπορούν να συνδεθούν μεταξύ τους σχηματίζοντας νέες φωσφορικές ενώσεις. Τα οργανικά φωσφορικά άλατα που αποτελούνται από ομάδες υδροξυλίου (-OH) έχουν όξινη φύση. Σε ένα υδατικό διάλυμα, αυτά τα φωσφορικά άλατα μπορούν να αποπρωτονιωθούν αφαιρώντας το άτομο Η στην ομάδα –ΟΗ. Στη συνέχεια, άλλες οργανικές ομάδες μπορούν να προσκολληθούν στο ιονισμένο οργανικό φωσφορικό άλας.
Το οργανικό φωσφορικό είναι το βασικό συστατικό για τα περισσότερα φυτοφάρμακα και άλλα λιπάσματα. Επιπλέον, τα οργανοφωσφορικά χρησιμοποιούνται ως πρόσθετα, διαλύτες, πλαστικοποιητές κ.λπ. Χρησιμοποιείται ως πρόσθετο υψηλής πίεσης για λιπαντικά και ως πλαστικοποιητής για την αύξηση της πλαστικότητας ή του ιξώδους ενός υλικού.
Τι είναι ένα Ανόργανο Φωσφορικό
Ένα ανόργανο φωσφορικό είναι ένα άλας του φωσφορικού οξέος. Εδώ, μια φωσφορική ομάδα συνδέεται με ένα μεταλλικό κατιόν. Το φωσφορικό άτομο βρίσκεται στο κέντρο και περιβάλλεται από τέσσερα άτομα οξυγόνου που συνδέονται χημικά με το άτομο του φωσφόρου. Η ομάδα φωσφορικών έχει συνολικό αρνητικό φορτίο -3. Επομένως, μπορεί να σχηματίσει μονοβασικά, διβασικά και τριβασικά άλατα. Η φωσφορική ομάδα έχει τετραεδρική διάταξη.
Τα ανόργανα φωσφορικά άλατα μπορούν να βρεθούν φυσικά. Συνήθως, αυτές οι ενώσεις μπορούν να βρεθούν ως άλατα στοιχείων της ομάδας 1, όπως νάτριο, κάλιο, ασβέστιο κ.λπ. Υπάρχουν δύο τύποι ανόργανων φωσφορικών ενώσεων:ορθοφωσφορικά και συμπυκνωμένα φωσφορικά.
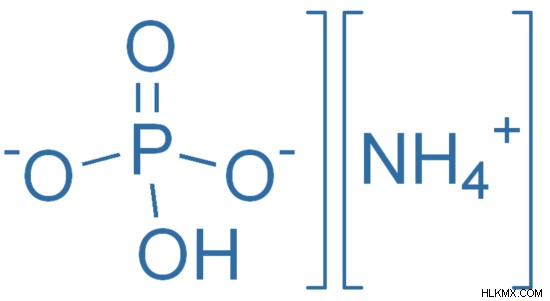
Εικόνα 2:Το φωσφορικό διαμμώνιο είναι ένα ανόργανο φωσφορικό
Τα ορθοφωσφορικά είναι δραστικές φωσφορικές ενώσεις. Αυτές είναι οι απλούστερες ενώσεις μεταξύ άλλων φωσφορικών και αποτελούνται από μία μονάδα φωσφορικών αλάτων. Ως εκ τούτου, αυτά ονομάζονται επίσης μονοφωσφορικά . Τα συμπυκνωμένα φωσφορικά άλατα αποτελούνται από περισσότερες από μία μονάδες φωσφορικών.
Τα ανόργανα φωσφορικά άλατα χρησιμοποιούνται επίσης ευρέως ως λιπάσματα. Για παράδειγμα, το υπερφωσφορικό και το τριπλό υπερφωσφορικό είναι κοινές ουσίες λιπασμάτων.
Διαφορά μεταξύ οργανικών και ανόργανων φωσφορικών
Ορισμός
Οργανικό φωσφορικό: Τα οργανικά φωσφορικά άλατα είναι εστέρες του φωσφορικού οξέος.
Ανόργανο φωσφορικό: Τα ανόργανα φωσφορικά είναι άλατα του φωσφορικού οξέος.
Χημικός δεσμός
Οργανικό φωσφορικό: Υπάρχουν μόνο ομοιοπολικοί δεσμοί μεταξύ της φωσφορικής ομάδας και της οργανικής ομάδας.
Ανόργανο φωσφορικό: Υπάρχουν ηλεκτροστατικές έλξεις μεταξύ της φωσφορικής ομάδας και του μεταλλικού κατιόντος.
Άλλες ομάδες
Οργανικό φωσφορικό: Τα οργανικά φωσφορικά έχουν οργανικές ομάδες συνδεδεμένες με φωσφορικές ομάδες.
Ανόργανο φωσφορικό: Τα ανόργανα φωσφορικά έχουν ανόργανες ομάδες συνδεδεμένες με φωσφορικές ομάδες.
Παραδείγματα
Οργανικό φωσφορικό: Παραδείγματα για οργανικά φωσφορικά άλατα περιλαμβάνουν το παραθείο, το μαλαθείο, κ.λπ.
Ανόργανο φωσφορικό: Παραδείγματα για τα ανόργανα φωσφορικά περιλαμβάνουν τα υπερφωσφορικά, τα τριπλά υπερφωσφορικά κ.λπ.
Συμπέρασμα
Τα φωσφορικά άλατα είναι ενώσεις που αποτελούνται από μονάδες φωσφορικών αλάτων. Υπάρχουν διάφοροι τύποι φωσφορικών αλάτων όπως τα οργανικά φωσφορικά και τα ανόργανα φωσφορικά άλατα. Η κύρια διαφορά μεταξύ των οργανικών φωσφορικών και των ανόργανων φωσφορικών είναι ότι τα οργανικά φωσφορικά είναι ενώσεις εστέρα ενώ τα ανόργανα φωσφορικά είναι ανόργανα άλατα.




