Διάκριση μεταξύ δυαδικών οξέων και οξυοξέων
Κύρια διαφορά – Δυαδικά οξέα έναντι Οξυοξέων
Τα δυαδικά οξέα και τα οξυοξέα είναι δύο τύποι όξινων ενώσεων. Τα δυαδικά οξέα είναι ενώσεις που περιέχουν πάντα ένα άτομο υδρογόνου συνδεδεμένο με ένα διαφορετικό στοιχείο. ως εκ τούτου είναι επίσης γνωστά ως υδροξέα . Εδώ, το άτομο υδρογόνου συνδέεται με ένα αμέταλλο όπως ένα αλογόνο, θείο κ.λπ. Τα οξυοξέα είναι ενώσεις που ουσιαστικά περιέχουν οξυγόνο. Η κύρια διαφορά μεταξύ δυαδικών οξέων και οξυοξέων είναι ότι τα δυαδικά οξέα έχουν τον γενικό τύπο H-X ενώ τα οξυοξέα έχουν τον γενικό τύπο H-O-X. Έτσι, ο γενικός τύπος αυτών των οξέων βοηθά στη διάκριση μεταξύ δυαδικών οξέων και οξυοξέων.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα δυαδικά οξέα
– Ορισμός, Παραδείγματα
2. Τι είναι τα Οξυοξέα
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Πώς να κάνετε διάκριση μεταξύ δυαδικών οξέων και οξυοξέων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:οξύ, δυαδικό οξύ, ηλεκτραρνητικότητα, αλογόνο, υδροξέα, οξυοξύ, μη μέταλλο

Τι είναι τα δυαδικά οξέα
Ένα δυαδικό οξύ είναι μια δυαδική ένωση όπου το ένα στοιχείο είναι υδρογόνο και το άλλο είναι ένα μη μέταλλο. Αυτές οι ενώσεις είναι επίσης γνωστές ως υδροξέα γιατί ουσιαστικά έχουν υδρογόνο. Το αμέταλλο είναι ένα χημικό στοιχείο στο μπλοκ p του περιοδικού πίνακα στοιχείων. Τα δυαδικά οξέα δεν είναι πάντα διατομικά μόρια. έχουν απλώς δύο διαφορετικά στοιχεία συνδεδεμένα μεταξύ τους. Το γενικό τυπικό είναι H-X.
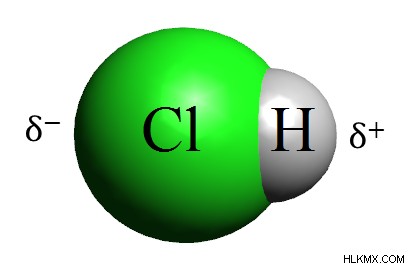
Εικόνα 1:Το HCl είναι δυαδικό οξύ
Τα δυαδικά οξέα είναι ικανά να δωρίσουν άτομα υδρογόνου στο μέσο (Η). Η ονοματολογία των δυαδικών οξέων έχει την ίδια δομή. Εάν το δυαδικό οξύ είναι σε καθαρή μορφή, το όνομα αρχίζει με "υδρογόνο" και το ανιονικό όνομα τελειώνει με "-ide". Ακολουθούν ορισμένα παραδείγματα δυαδικών οξέων.
- Διατομικά δυαδικά οξέα – HCl, HI, κ.λπ.
- Πολυατομικά δυαδικά οξέα – H2 S
- Δυαδικά οξέα που περιέχουν αλογόνο – HF, HCl, HBr και HI
Τι είναι τα οξυοξέα
Ένα οξυοξύ είναι ένα οξύ που περιέχει ένα άτομο οξυγόνου συνδεδεμένο με ένα άτομο υδρογόνου και τουλάχιστον ένα άλλο στοιχείο. Η γενική δομή ενός οξυοξέος είναι Η-Ο-Χ. Μια ένωση που έχει αυτόν τον τύπο μπορεί να διαχωριστεί στο υδατικό μέσο με δύο διαφορετικούς τρόπους όπως δίνονται παρακάτω.
X−O−H ⇄ (X−O) + H
X−O−H ⇄ X + OH
Αν το άτομο Χ έχει υψηλή ηλεκτραρνητικότητα, τότε τα ηλεκτρόνια του ατόμου οξυγόνου έλκονται από αυτό. Τότε ο δεσμός μεταξύ οξυγόνου και υδρογόνου γίνεται αδύναμος. Ως αποτέλεσμα, το άτομο υδρογόνου απελευθερώνεται όπως δίνεται στην πρώτη εξίσωση. Αυτός ο τύπος αντίδρασης δίνεται από οξυοξέα.
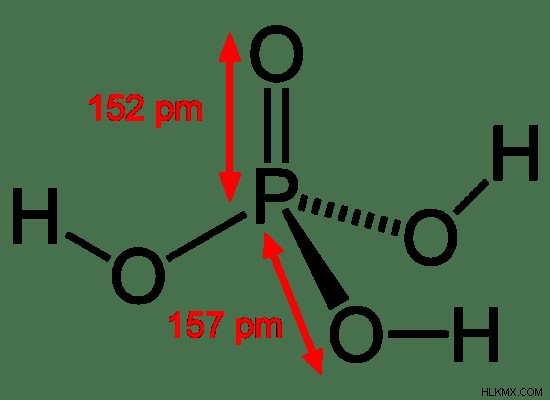
Εικόνα 2:Το φωσφορικό οξύ είναι οξυοξύ
Αλλά εάν η ηλεκτραρνητικότητα του Χ είναι χαμηλή, τείνει να απελευθερώνει ιόντα υδροξειδίου όπως δίνεται στη δεύτερη εξίσωση. Παράδειγμα:NaOH. Αυτές οι ενώσεις μπορεί μερικές φορές να είναι αμφοτερικές εάν η ηλεκτραρνητικότητα του Χ είναι μέτρια τιμή. Αυτός ο τύπος αντιδράσεων δίνεται από τα "οξοξέα".
Παραδείγματα:
- Οξυοξέα του θείου – H2 SO4 , H2 SO3
- Οξυοξέα του φωσφόρου – H3 PO4
- Οξυοξέα αζώτου – HNO3 , HNO2
Διάκριση μεταξύ δυαδικών οξέων και οξυοξέων
Ορισμός
Δυαδικά οξέα: Ένα δυαδικό οξύ είναι μια δυαδική ένωση όπου το ένα στοιχείο είναι υδρογόνο και το άλλο είναι ένα μη μέταλλο.
Οξυοξέα: Ένα οξυοξύ είναι ένα οξύ που περιέχει ένα άτομο οξυγόνου συνδεδεμένο με ένα άτομο υδρογόνου και τουλάχιστον ένα άλλο στοιχείο.
Στοιχεία
Δυαδικά οξέα: Τα δυαδικά οξέα περιέχουν ουσιαστικά ένα άτομο υδρογόνου συνδεδεμένο με ένα άλλο στοιχείο.
Οξυοξέα: Τα οξυοξέα περιέχουν ουσιαστικά τουλάχιστον ένα άτομο οξυγόνου.
Οξυγόνο
Δυαδικά οξέα: Τα δυαδικά οξέα δεν περιέχουν οξυγόνο.
Οξυοξέα: Τα οξυοξέα περιέχουν ουσιαστικά οξυγόνο.
Δύναμη
Δυαδικά οξέα: Η ισχύς ενός οξέος καθορίζεται από την ισχύ του δεσμού μεταξύ του δεσμού Η-Χ σε δυαδικά οξέα.
Οξυοξέα: Η ισχύς ενός οξέος καθορίζεται από την ηλεκτραρνητικότητα του κεντρικού ατόμου Χ στα οξυοξέα.
Γενικός τύπος
Δυαδικά οξέα: Ο γενικός τύπος των δυαδικών οξέων είναι H-X.
Οξυοξέα: Ο γενικός τύπος των οξυοξέων είναι H-O-X.
Συμπέρασμα
Τα δυαδικά οξέα είναι ενώσεις που περιέχουν άτομα υδρογόνου συνδεδεμένα με ένα διαφορετικό χημικό στοιχείο. Τα οξυοξέα είναι όξινες ενώσεις που περιέχουν τουλάχιστον ένα άτομο οξυγόνου. Είναι ο γενικός τύπος αυτών των οξέων που βοηθά στη διάκριση μεταξύ δυαδικών οξέων και οξυοξέων. Τα δυαδικά οξέα έχουν τον γενικό τύπο H-X ενώ τα οξυοξέα έχουν τον γενικό τύπο H-O-X.
Αναφορά:
1. Helmenstine, Anne Marie. "Ο ορισμός του δυαδικού οξέος." ThoughtCo, 23 Ιουνίου 2014, Διαθέσιμο εδώ.
2. Helmenstine, Anne Marie. "Ορισμός οξυοξέων και παραδείγματα." ThoughtCo, 10 Οκτωβρίου 2017, Διαθέσιμο εδώ.
3. Zumdahl, Steven S. «Oxyacid». Encyclopædia Britannica, Encyclopædia Britannica, inc., 15 Αυγούστου 2008, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Dipolna molekula HCl» Του Drago Karlo – Δικό έργο (CC BY-SA 4.0) μέσω Commons Wikimedia
2. "Phosphoric-acid-2D-dimensions" (Public Domain) μέσω Commons Wikimedia




