Πώς σχηματίζονται δεσμοί αιθάνης με διαγράμματα;
Το αιθάνιο είναι ένα μόριο υδρογονανθράκων με τον χημικό τύπο C2H6. Αποτελείται από δύο άτομα άνθρακα και έξι άτομα υδρογόνου. Τα άτομα άνθρακα συνδέονται μαζί με έναν μόνο ομοιοπολικό δεσμό και κάθε άτομο άνθρακα συνδέεται με τρία άτομα υδρογόνου με μεμονωμένους ομοιοπολικούς δεσμούς.
Βήμα 1:Σχηματισμός του δεσμού άνθρακα-άνθρακα
Το πρώτο βήμα στον σχηματισμό αιθάνης είναι ο σχηματισμός του δεσμού άνθρακα-άνθρακα. Αυτό συμβαίνει όταν δύο άτομα άνθρακα πλησιάζουν ο ένας τον άλλον και τα εξώτατα κελύφη ηλεκτρονίων αρχίζουν να επικαλύπτονται. Τα ηλεκτρόνια σε αυτά τα κελύφη στη συνέχεια μοιράζονται μεταξύ των δύο ατόμων, σχηματίζοντας έναν ομοιοπολικό δεσμό.
[Εικόνα δύο ατόμων άνθρακα που πλησιάζουν το ένα το άλλο και τα εξωτερικά κελύφη ηλεκτρονίων τους αρχίζουν να επικαλύπτονται]
Βήμα 2:Σχηματισμός των δεσμών άνθρακα-υδρογόνου
Μόλις σχηματιστεί ο δεσμός άνθρακα-άνθρακα, το επόμενο βήμα είναι ο σχηματισμός των δεσμών άνθρακα-υδρογόνου. Αυτό συμβαίνει όταν τα άτομα υδρογόνου πλησιάζουν τα άτομα άνθρακα και τα εξωτερικά κελύφη ηλεκτρονίων τους αρχίζουν να επικαλύπτονται με τα εξώτατα κελύφη ηλεκτρονίων των ατόμων άνθρακα. Τα ηλεκτρόνια σε αυτά τα κελύφη στη συνέχεια μοιράζονται μεταξύ των ατόμων, σχηματίζοντας ομοιοπολικούς δεσμούς.
[Εικόνα δύο ατόμων άνθρακα που συνδέονται μαζί με έναν ομοιοπολικό δεσμό και έξι άτομα υδρογόνου που πλησιάζουν τα άτομα άνθρακα]
Βήμα 3:Ολοκλήρωση του μορίου αιθάνης
Μόλις σχηματιστούν όλοι οι δεσμοί άνθρακα-υδρογόνου, το μόριο αιθάνης έχει ολοκληρωθεί. Το μόριο αποτελείται από δύο άτομα άνθρακα που συνδέονται μαζί με έναν μόνο ομοιοπολικό δεσμό και κάθε άτομο άνθρακα συνδέεται με τρία άτομα υδρογόνου με μεμονωμένους ομοιοπολικούς δεσμούς.
[Εικόνα του ολοκληρωμένου μορίου αιθάνης]
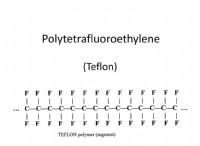
Δομική φόρμουλα αιθάνης
Ο δομικός τύπος αιθάνης είναι H3C-CH3. Αυτός ο τύπος δείχνει ότι κάθε άτομο άνθρακα συνδέεται με τρία άτομα υδρογόνου και ότι τα δύο άτομα άνθρακα συνδέονται μεταξύ τους με έναν μόνο δεσμό.
δομή lewis dot του αιθάνης
Η δομή Lewis Dot του αιθάνης είναι:
`` `
Η:Γ:Η
|
Η:Γ:Η
`` `
Αυτή η δομή δείχνει τα ηλεκτρόνια σθένους κάθε ατόμου και πώς μοιράζονται μεταξύ των ατόμων για να σχηματίσουν ομοιοπολικούς δεσμούς.