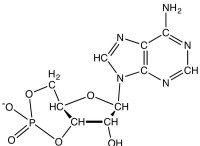
Τι είναι ένας δεσμός υδρογόνου πώς λειτουργούν θα περιγράφατε αυτούς τους δεσμούς ως ισχυροί ή αδύναμοι;
Πώς λειτουργούν οι δεσμοί υδρογόνου;
Οι δεσμοί υδρογόνου σχηματίζονται λόγω της διαφοράς στην ηλεκτροαρνητικότητα μεταξύ του υδρογόνου και του ατόμου που συνδέεται με. Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια προς τον εαυτό του. Όταν το υδρογόνο συνδέεται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο, το ηλεκτροαρνητικό άτομο τραβά τα ηλεκτρόνια μακριά από το υδρογόνο, δημιουργώντας μια μικρή ανισορροπία στην κατανομή των ηλεκτρονίων. Αυτό έχει ως αποτέλεσμα ένα μερικό θετικό φορτίο στο άτομο υδρογόνου και ένα μερικό αρνητικό φορτίο στο ηλεκτροαρνητικό άτομο.
Το μερικό θετικό φορτίο στο άτομο υδρογόνου μπορεί στη συνέχεια να αλληλεπιδράσει με το μερικό αρνητικό φορτίο σε ένα άλλο ηλεκτροαρνητικό άτομο σε ένα κοντινό μόριο. Αυτή η αλληλεπίδραση είναι αυτό που σχηματίζει τον δεσμό υδρογόνου. Οι δεσμοί υδρογόνου συνήθως αντιπροσωπεύονται από μια διακεκομμένη γραμμή μεταξύ του ατόμου υδρογόνου και του ηλεκτροαρνητικού ατόμου.
Οι δεσμοί υδρογόνου είναι ισχυροί ή αδύναμοι;
Οι δεσμοί υδρογόνου θεωρούνται γενικά αδύναμοι χημικοί δεσμοί σε σύγκριση με ομοιοπολικούς δεσμούς ή ιοντικούς δεσμούς. Η αντοχή ενός δεσμού υδρογόνου εξαρτάται από διάφορους παράγοντες, συμπεριλαμβανομένης της ηλεκτροαρνητικότητας των εμπλεκόμενων ατόμων, της απόστασης μεταξύ των ατόμων και της παρουσίας άλλων κοντινών ατόμων ή μορίων.
Γενικά, οι δεσμοί υδρογόνου είναι ισχυρότεροι όταν η διαφορά ηλεκτροαρνητικότητας μεταξύ των εμπλεκόμενων ατόμων είναι μεγαλύτερη. Για παράδειγμα, ο δεσμός υδρογόνου μεταξύ αζώτου και υδρογόνου είναι ισχυρότερος από τον δεσμό υδρογόνου μεταξύ οξυγόνου και υδρογόνου. Οι δεσμοί υδρογόνου είναι επίσης ισχυρότεροι όταν η απόσταση μεταξύ των ατόμων είναι μικρότερη.
Η παρουσία άλλων κοντινών ατόμων ή μορίων μπορεί επίσης να επηρεάσει τη δύναμη των δεσμών υδρογόνου. Για παράδειγμα, η παρουσία μορίων νερού μπορεί να ενισχύσει τους δεσμούς υδρογόνου, ενώ η παρουσία μη πολικών μορίων μπορεί να αποδυναμώσει τους δεσμούς υδρογόνου.
Παρά τη σχετικά αδύναμη φύση τους, οι δεσμοί υδρογόνου διαδραματίζουν καθοριστικό ρόλο σε πολλές βιολογικές και χημικές διεργασίες. Είναι υπεύθυνοι για τη δομή πολλών βιολογικών μορίων, όπως το DNA και τις πρωτεΐνες, και διαδραματίζουν επίσης ρόλο στις αλληλεπιδράσεις μεταξύ μορίων σε νερό και άλλους πολικούς διαλύτες.