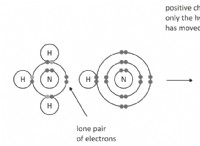
Πώς ονομάζετε μια ένωση όταν τα στοιχεία βρίσκονται στον ίδιο περιοδικό πίνακα στη στήλη;
Εδώ είναι μια κατανομή:
1. Προσδιορίστε τα στοιχεία:
* Προσδιορίστε ποιο στοιχείο είναι περισσότερο ηλεκτροαρνητικό. Η ηλεκτροαρνητικότητα γενικά αυξάνεται καθώς ανεβαίνετε προς τα πάνω και προς τα δεξιά στον περιοδικό πίνακα.
* Το πιο ηλεκτροαρνητικό στοιχείο θα ονομαστεί δεύτερο στο όνομα της ένωσης (ως ανιόν).
2. Ονομάστε τα κατιόντα:
* μέταλλα: Τα περισσότερα μέταλλα έχουν σταθερή φόρτιση, οπότε το όνομά τους παραμένει αμετάβλητο (π.χ. νάτριο, κάλιο).
* Μη μετάλλια: Τα μη μέταλλα μπορούν να σχηματίσουν πολλαπλά ανιόντα. Χρησιμοποιήστε τους ρωμαϊκούς αριθμούς για να υποδείξετε το φορτίο του κατιόντος σε παρενθέσεις μετά το όνομα του στοιχείου (π.χ., φωσφόρος (III), χλώριο (V)).
3. Ονομάστε τα ανιόντα:
* Προσθέστε το επίθημα "-IDE" στο όνομα της ρίζας του μη μεταλλικού (π.χ. χλωριούχο, σουλφίδιο, οξείδιο).
* Τα μη μέταλλα μπορούν να έχουν πολλαπλά ανιόντα. Χρησιμοποιήστε τα προθέματα όπως το "Hypo-" (λιγότερο οξυγόνο), "-ITE" (λιγότερα οξυγόνο), "-ΑΤ" (περισσότερο οξυγόνο) και "pER-" (το μεγαλύτερο οξυγόνο) για να υποδείξετε τον σχετικό αριθμό ατόμων οξυγόνου.
Παραδείγματα:
* οξυγόνο και θείο: Το οξυγόνο είναι πιο ηλεκτροαρνητικό.
* οξυγόνο (O) + θείο (s) → οξείδιο του θείου (SO)
* οξυγόνο (O) + θείο (S) → Διοξείδιο του θείου (SO2)
* Οξυγόνο (O) + θείο (S) → Τριογείο θείου (SO3)
* αζώτου και φωσφόρου: Ο φωσφόρος είναι πιο ηλεκτροαρνητικός.
* αζώτου (N) + φωσφόρος (P) → φωσφίδιο αζώτου (NP)
* Κάλυψη και νάτριο: Και τα δύο είναι μέταλλα.
* Κάλιο (k) + νάτριο (Na) → Κολικό νάτριο (Kna) (Αυτή είναι μια διαμεταλλική ένωση)
Βασικά σημεία:
* Προθέματα: Χρησιμοποιήστε προθέματα όπως "di-", "tri-", "tetra-", κλπ., Για να υποδείξετε τον αριθμό των ατόμων κάθε στοιχείου στην ένωση.
* χρεώσεις: Βεβαιωθείτε ότι το υπόλοιπο των χρεώσεων για τη συνολική ένωση.
* Διαμεταλλικές ενώσεις: Οι ενώσεις μεταξύ δύο μετάλλων αναφέρονται συνήθως ως "διαμεταλλικές ενώσεις" και ονομάζονται απλώς με την απαρίθμηση των μετάλλων κατά σειρά αύξησης της ηλεκτροαρνητικότητας.
Θυμηθείτε: Ο χημικός τύπος της ένωσης θα υπαγορεύει πάντα το ακριβές όνομα. Αυτοί οι κανόνες παρέχουν μια κατευθυντήρια γραμμή για την ονομασία ενώσεων, αλλά είναι απαραίτητο να κατανοήσουμε τις συγκεκριμένες ιδιότητες κάθε στοιχείου.