Τι είναι το ατομικό μοντέλο Dalton;
Το ατομικό μοντέλο Dalton είναι ένα μοντέλο του ατόμου που προτάθηκε από τον John Dalton. Το μοντέλο βασίστηκε στους νόμους της διατήρησης της μάζας, των σταθερών αναλογιών, των πολλαπλών αναλογιών και των αμοιβαίων αναλογιών. Το μοντέλο υπέθεσε ότι τα άτομα είναι μικροσκοπικά αδιαίρετα σφαιρικά αντικείμενα που δεν μπορούν να διαιρεθούν περαιτέρω. Το μοντέλο αργότερα διαψεύστηκε με την ανακάλυψη του πυρήνα, των πρωτονίων και των ηλεκτρονίων.
Για κάποιον να σκέφτεται πέρα από τις κατασκευές και τα όρια της διάνοιάς του είναι δύσκολο, αλλά για ένα άτομο να συλλάβει κάτι που δεν έχει φανταστεί ποτέ κανένας άλλος ανθρώπινος νους είναι ένα κατόρθωμα που ανήκει στον εγκέφαλο μιας ιδιοφυΐας. Αυτό ακριβώς έκανε ο Τζον Ντάλτον. Μεγάλο μέρος του Ατομικού Μοντέλου Dalton έχει διαψευσθεί, αλλά εξακολουθεί να θεωρείται ο άνθρωπος που έθεσε τα θεμέλια για την ατομική θεωρία που γιορτάζουμε σήμερα. Πριν βουτήξουμε στο ατομικό μοντέλο Dalton, ας κάνουμε μια σύντομη επισκόπηση της ατομικής θεωρίας που είχε δημιουργηθεί πριν από αυτό.

(Φωτογραφία:Charles Turner/Wikimedia Commons)
Οι βασικοί νόμοι της ατομικής θεωρίας
Το πρώτο πράγμα που θα εξετάσουμε είναι ο Νόμος της διατήρησης της μάζας . Ήταν ένας νόμος που θεσπίστηκε από τον Antoine Lavoisier το 1789. Ο νόμος της διατήρησης της μάζας ορίζει ότι η καθαρή μεταβολή της μάζας των αντιδρώντων και των προϊόντων μετά από μια χημική αντίδραση είναι μηδέν. Αυτό σημαίνει ότι η μάζα δεν μπορεί ούτε να καταστραφεί ούτε να δημιουργηθεί. Αυτό σημαίνει ότι η μάζα παραμένει πάντα σταθερή σε μια χημική αντίδραση. Μερικές ανακρίβειες σημειώθηκαν αργότερα σε αυτόν τον νόμο, λόγω του γεγονότος ότι κατά τη διάρκεια ορισμένων αντιδράσεων, η μάζα μπορεί να αλληλομετατραπεί με τη θερμότητα και την ενέργεια του δεσμού.
Ο δεύτερος νόμος είναι ο Νόμος των σταθερών αναλογιών . Ο νόμος των σταθερών αναλογιών δηλώνει ότι όταν μια ένωση σπάσει, η μάζα των συστατικών στοιχείων παραμένει στην ίδια αναλογία. Η σημασία αυτού του νόμου έγκειται στο γεγονός ότι η μάζα κάθε ένωσης έχει τα ίδια στοιχεία στις ίδιες αναλογίες, ανεξάρτητα από το πού έγινε η ένωση, πού ελήφθη ή τη μάζα της ένωσης.
Ο επόμενος νόμος είναι ο νόμος των πολλαπλών αναλογιών, που αναφέρει ότι όταν δύο στοιχεία σχηματίζουν δύο ή περισσότερες ενώσεις μεταξύ τους, η αναλογία των μαζών του δεύτερου στοιχείου σε κάθε ένωση μπορεί να εκφραστεί με τη μορφή μικρών ακέραιων αριθμών. Ο νόμος προτάθηκε από τον ίδιο τον Dalton μετά από μελέτη των δύο προηγούμενων νόμων.
Ο τέταρτος και τελευταίος νόμος είναι ονόμος των αμοιβαίων αναλογιών, που δηλώνει ότι όταν δύο διαφορετικά στοιχεία συνδυάζονται με την ίδια ποσότητα ενός τρίτου στοιχείου, η αναλογία στην οποία το κάνουν θα είναι η ίδια ή πολλαπλάσιο της αναλογίας στην οποία συνδυάζονται. Ο James Ritcher πρότεινε αυτόν τον νόμο το 1792.
Ατομικό μοντέλο John Dalton
Με βάση τους παραπάνω νόμους που θεσπίστηκαν, ο Dalton διατύπωσε την ιδέα του για τη θεμελιώδη φύση της ύλης, έτσι κατέληξε στην έννοια των ατόμων. Αφού μελέτησε τους παραπάνω νόμους με μεγάλη προσοχή, κατέληξε στα ακόλουθα αξιώματα:
- Η ύλη αποτελείται από πολύ μικροσκοπικά σωματίδια που ονομάζονται άτομα .
- Τα άτομα είναι αδιαίρετες δομές που δεν μπορούν ούτε να δημιουργηθούν ούτε να καταστραφούν κατά τη διάρκεια μιας χημικής αντίδρασης (βάσει του νόμου της διατήρησης της μάζας).
- Όλα τα άτομα ενός συγκεκριμένου στοιχείου είναι παρόμοια από κάθε άποψη, συμπεριλαμβανομένων των φυσικών ή χημικών ιδιοτήτων τους.
- Αντίστροφα, τα άτομα διαφορετικών στοιχείων παρουσιάζουν διαφορετικές ιδιότητες, έχουν διαφορετικές μάζες και διαφορετικές χημικές ιδιότητες.
- Ο σχετικός αριθμός και τα είδη των ατόμων σε μια δεδομένη ένωση βρίσκονται πάντα σε σταθερή αναλογία (βάσει του νόμου των σταθερών αναλογιών).
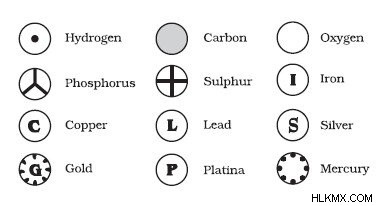 Με βάση τα παραπάνω αξιώματα, ο Dalton μπόρεσε να καταλήξει σε ένα από τα πρώτα μοντέλα για το άτομο. Ένα άλλο όνομα για το μοντέλο του είναι το μοντέλο της μπάλας του μπιλιάρδου. Όρισε τα άτομα ως μικροσκοπικά αδιαίρετα σφαιρικά αντικείμενα που δεν μπορούν να διαιρεθούν περαιτέρω. Δεν γνώριζε εκείνη την εποχή (όπως όλοι, για εκείνο το θέμα) την έννοια του πυρήνα, των πρωτονίων ή των ηλεκτρονίων. Αν είχατε ζητήσει από τον Dalton να σχεδιάσει ένα άτομο, θα είχε απλώς σχεδιάσει έναν κύκλο!
Με βάση τα παραπάνω αξιώματα, ο Dalton μπόρεσε να καταλήξει σε ένα από τα πρώτα μοντέλα για το άτομο. Ένα άλλο όνομα για το μοντέλο του είναι το μοντέλο της μπάλας του μπιλιάρδου. Όρισε τα άτομα ως μικροσκοπικά αδιαίρετα σφαιρικά αντικείμενα που δεν μπορούν να διαιρεθούν περαιτέρω. Δεν γνώριζε εκείνη την εποχή (όπως όλοι, για εκείνο το θέμα) την έννοια του πυρήνα, των πρωτονίων ή των ηλεκτρονίων. Αν είχατε ζητήσει από τον Dalton να σχεδιάσει ένα άτομο, θα είχε απλώς σχεδιάσει έναν κύκλο!
 Πραγματικά προσπάθησε να ταξινομήσει τα άτομα και ήταν ο πρώτος επιστήμονας που έδωσε σύμβολα σε διαφορετικά στοιχεία. Ωστόσο, παρά τις καλύτερες προσπάθειές του, πολλές αποκλίσεις και πλάνες μπήκαν στο ίδιο το θεμέλιο της θεωρίας του. Το δεύτερο αξίωμα τελικά δεν μπορούσε πλέον να γίνει αποδεκτό, καθώς το άτομο θα μπορούσε περαιτέρω να χωριστεί σε πρωτόνια, νετρόνια και ηλεκτρόνια σύμφωνα με τοΜοντέλο Bohr του ατόμου. Το τρίτο αξίωμα βρέθηκε επίσης ψευδές, καθώς τα ισότοπα είναι το ίδιο στοιχείο, αλλά έχουν διαφορετική ατομική δομή. Τέλος, το τέταρτο αξίωμα αποδείχθηκε επίσης λάθος λόγω της ύπαρξης ισοβαρών, οι οποίες είναι άτομα διαφορετικών στοιχείων που έχουν την ίδια μάζα.
Πραγματικά προσπάθησε να ταξινομήσει τα άτομα και ήταν ο πρώτος επιστήμονας που έδωσε σύμβολα σε διαφορετικά στοιχεία. Ωστόσο, παρά τις καλύτερες προσπάθειές του, πολλές αποκλίσεις και πλάνες μπήκαν στο ίδιο το θεμέλιο της θεωρίας του. Το δεύτερο αξίωμα τελικά δεν μπορούσε πλέον να γίνει αποδεκτό, καθώς το άτομο θα μπορούσε περαιτέρω να χωριστεί σε πρωτόνια, νετρόνια και ηλεκτρόνια σύμφωνα με τοΜοντέλο Bohr του ατόμου. Το τρίτο αξίωμα βρέθηκε επίσης ψευδές, καθώς τα ισότοπα είναι το ίδιο στοιχείο, αλλά έχουν διαφορετική ατομική δομή. Τέλος, το τέταρτο αξίωμα αποδείχθηκε επίσης λάθος λόγω της ύπαρξης ισοβαρών, οι οποίες είναι άτομα διαφορετικών στοιχείων που έχουν την ίδια μάζα.
Αφού ο J.J. Ο Thompson ανακοίνωσε το μοντέλο του ατόμου, το οποίο ενίσχυσε αυτό που ήταν αλήθεια στα υπόλοιπα αξιώματα του Dalton. Αργότερα, ο Ράδερφορντ συνδύασε τόσο τις ιδέες του Ντάλτον όσο και του Τόμσον και κατέληξε σε ένα σχεδόν ακριβές μοντέλο για το άτομο. Τελικά χρειάστηκε ο Niels Bohr και το κβαντομηχανικό μοντέλο για να δημιουργήσουν το σύγχρονο ατομικό μοντέλο που γνωρίζουμε και θαυμάζουμε σήμερα!




