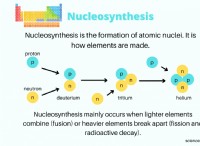
Γιατί το διάλυμα ανθρακικού νατρίου είναι αλκαλική φύση;
1. Υδρόλυση ανθρακικών ιόντων:
* Όταν το ανθρακικό νάτριο διαλύεται στο νερό, διαχωρίζεται σε ιόντα νατρίου (Na⁺) και ιόντα ανθρακικού άλατος (Co₃2⁻).
* Τα ιόντα ανθρακικού άλατος αντιδρούν με μόρια νερού σε μια διαδικασία που ονομάζεται υδρόλυση, σχηματίζοντας ιόντα διττανθρακικού (HCO₃⁻) και ιόντα υδροξειδίου (OH⁻):
`` `
(Aq) + h₂o (l) ⇌ hco₃⁻ (aq) + oh⁻ (aq)
`` `
* Η παρουσία ιόντων υδροξειδίου (OH⁻) στο διάλυμα το καθιστά αλκαλικό.
2. Αδύναμο οξύ και ισχυρό αλάτι βάσης:
* Το ανθρακικό νάτριο σχηματίζεται από την αντίδραση μιας ισχυρής βάσης (υδροξείδιο νατρίου, ΝΑΟΗ) και ενός ασθενούς οξέος (καρβονικό οξύ, H₂co₃).
* Τα άλατα που σχηματίζονται από ισχυρές βάσεις και αδύναμα οξέα τείνουν να έχουν αλκαλική φύση.
3. τιμή pH:
* Το ρΗ ενός διαλύματος ανθρακικού νατρίου είναι μεγαλύτερο από 7, υποδεικνύοντας την αλκαλική του φύση.
Συνοπτικά:
Η υδρόλυση των ιόντων ανθρακικού άλατος στο νερό παράγει ιόντα υδροξειδίου, τα οποία είναι υπεύθυνα για την αλκαλική φύση του διαλύματος ανθρακικού νατρίου. Η παρουσία ιόντων υδροξειδίου οδηγεί σε υψηλότερη τιμή ρΗ από 7, επιβεβαιώνοντας την αλκαλικότητά του.