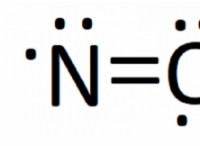Τι αποτέλεσμα έχει η προσθήκη διαλυτή ουσιών στο σημείο κατάψυξης μιας λύσης;
Εδώ είναι γιατί:
* Διαταραχή της δομής διαλύτη: Όταν διαλύεται μια διαλυμένη ουσία σε έναν διαλύτη, διαταράσσει την κανονική διάταξη των μορίων διαλύτη. Αυτό καθιστά πιο δύσκολο για τα μόρια του διαλύτη να σχηματίσουν μια στερεή (κατεψυγμένη) δομή.
* αλληλεπιδράσεις διαλυτή διαλύτη: Τα μόρια διαλυμένης ουσίας και διαλύτη αλληλεπιδρούν μεταξύ τους, εξασθενίζοντας τις ελκυστικές δυνάμεις μεταξύ των μορίων διαλύτη και καθιστώντας λιγότερο πιθανό να παγώσει ο διαλύτης.
* Colligative Property: Η κατάθλιψη σημείων κατάψυξης είναι μια περιεκτική ιδιότητα, που σημαίνει ότι εξαρτάται μόνο από τη συγκέντρωση σωματιδίων ουσίας, όχι για την ειδική τους ταυτότητα. Όσο πιο διαλυμένα σωματίδια υπάρχουν, τόσο μεγαλύτερη είναι η κατάθλιψη στο σημείο κατάψυξης.
Παράδειγμα:
Η προσθήκη αλατιού στο νερό μειώνει το σημείο κατάψυξης του νερού. Αυτός είναι ο λόγος για τον οποίο το αλάτι χρησιμοποιείται για να λιώσει τον πάγο στους δρόμους το χειμώνα. Το αλάτι διαλύεται στο νερό, μειώνοντας το σημείο κατάψυξης και εμποδίζοντας τον σχηματισμό του πάγου.
Φόρμουλα:
Η κατάθλιψη του σημείου κατάψυξης (ΔTF) μπορεί να υπολογιστεί χρησιμοποιώντας τον ακόλουθο τύπο:
Δtf =kf * m
όπου:
* Το ΔTF είναι η κατάθλιψη του σημείου κατάψυξης
* Το KF είναι η σταθερά κατάθλιψης σημείου κατάψυξης (ιδιότητα του διαλύτη)
* m είναι η μολικότητα του διαλύματος (γραμμομονείς διαλυμένης ουσίας ανά χιλιόγραμμο διαλύτη)